Типы химических связей. Химическая связь
реклама

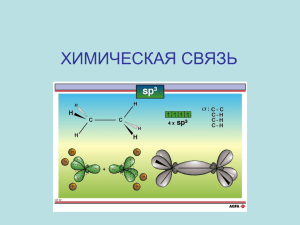
Типы химических связей. Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решётке в результате действия между атомами электрических сил притяжения. Появление атомной модели Бора, впервые объяснившей строение электронной оболочки, способствовало созданию представления о химической связи и её электронной природе. В 1915г. немецкий физик Коссель дал объяснение химической связи в солях, а в 1916 году американский учёный Льюис предложил трактовку химической связи в молекулах. Леонард Альбрехт Коссель Гилберт-Ньютон Льюис Различают три основных типа химической связи: ковалентную, ионную, металлическую. Химическая связь Ковалентная Полярная Неполярная Ионная Металлическая Ковалентная связь образуется, когда два атома могут «обобщить» электроны: А . + В . → А:В КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ (КНС) - образуют атомы одного и того же химического элемента неметалла (Например, H2, O2, О3). КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ (КПС) - образуют атомы разных неметаллов, отличающихся по значениям электроотрицательности (Например, HCl, H2O). Ионная связь - это химическая связь, образованная за счет электростатического притяжения между катионами и анионами. Металлическая связь — связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу.