CH3
реклама

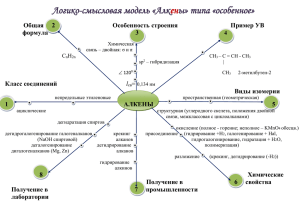
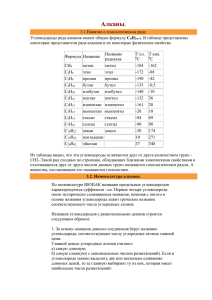
Урок химии по теме «Предельные углеводороды» (алканы) Автор: Бурцева Нина Николаевна, преподаватель химии КГА ПОУ «ПТК» План урока: 1. Формула алканов. 2. Строение молекулы алканов. 3. Физические свойства алканов. 4. Гомологи. Изомерия. Номенклатура. 5. Химические свойства алканов. 6. Нахождение алканов в природе. 7. Методы получения алканов. 8. Применение алканов. АЛКАНЫ (предельные, насыщенные, парафины) – органические вещества, состоящие из атомов углерода и водорода, связанных между собой одинарными (сигма) связями. Пространственное Общая формула CnH2n+2. строение молекулы метана Молекулярная формула молекулы метана CH4 Строение Атом углерода Тип гибридизации sp 3. Валентный угол 1090 28/, расстояние между атомами 0,154 нм Физические свойства С16Н34…и С5Н12…C15Н32 далее– СН4…C4Н10 – – жидкости твёрдые газы T кипения: вещества T кипения: T кипения: - 161,6…- 0,5 °C 36,1…270,5 °C T плавления: 287,5 °C T плавления: T плавления: -182,5…-138,3 °C -129,8…10 °C 20 °C С увеличением относительных молекулярных масс предельных углеводородов закономерно повышаются их температуры кипения и плавления. Гомологический ряд метана СН4 С2H6 C3H8 C4H10 C5H12 метан этан пропан бутан пентан C6H14 C7H16 C8H18 C9H20 C10H22 гексан гептан октан нонан декан Номенклатура алканов Алгоритм. 1. Выбор главной цепи: CH3 – CH - CH2 - CH3 │ CH3 Номенклатура алканов 2. Нумерация атомов главной цепи: 1 2 3 4 CH3 – CH - CH2 - CH3 │ CH3 Номенклатура алканов 3. Формирование названия: 1 2 3 4 CH3 – CH - CH2 - CH3 │ CH3 2 - метилбутан Радикал – это частица, имеющая неспаренные электроны. Число Название числа Формула радикала Название радикала 1 Моно- -СН3 Метил 2 Ди- -С2Н5 Этил 3 Три- -С3Н7 Пропил 4 Тетра- -С4Н9 Бутил 5 Пента- -С5Н11 Пентил Ароматизация Алканы с 6 и более атомами углерода вступают в реакции дегидрирования с образованием цикла (дегидроциклизации) : Получение: • Реакция Вюрца • Разложение солей карбоновых кислот • Гидрирование ненасыщенных углеводородов Синтез Вюрца проводят с целью получения алканов с более длинной углеродной цепью. Например: получение этана из метана 1 этап. Галогенирование исходного алкана СН4 + Сl2 = CH3Cl + HCl 2 этап. Взаимодействие с натрием 2CH3Cl + 2Na = C2H6 + 2NaCl МЕТАН – газ, без цвета и запаха, почти в 2 раза легче воздуха, мало растворим в воде. Он образуется в природе в результате разложения без доступа воздуха остатков растительных и животных организмов. Поэтому может быть обнаружен в заболоченных водоемах, где появляется в виде пузырьков газа, или накапливается в каменноугольных шахтах, куда выделяется из угольных пластов. В значительном количестве (80-97%) метан содержится в природном газе и в попутных нефтяных газах.. Практическое применение Закрепление 1. Найдите формулу алканов: CnH2n, CnH2n+2, CnHn+2, CnHn. 2. Назовите агрегатное состояние бутана. 3. Напишите гомологи пропана. 4. Что образуется в результате горения метана? 5. Напишите полную структурную формулу алкана по названию 2,2 диметилбутан. 1 2 3 4 6.Составьте название алкана СН3 – СН – СН – СН3 по структурной формуле: СН3 СН3 7. Как в вашей будущей профессии используют алканы? Список использованной литературы 1. Схемы: Химия Пособие-репетитор / сост. А.С. Егоров Ростов-на-Дону: Феникс, 1997. 2. Химия для профессий и специальностей технического профиля/Габриелян О.С. –М.: Издательский центр «Академия», 2012. 3. festival.1september.ru 4. prezentacii.com 5. present5.com Спасибо за работу!