pptx Химическая связь-лекция 1 Размер: 6880 кБ
реклама

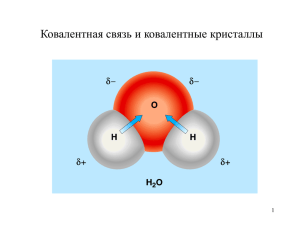
Химическая связь Взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы АТОМ Стремление к завершению электронного уровня (в зависимости от радиуса и числа электронов на внешнем слое) (отдать внешние электроны) МЕТАЛЛЫ (принять электроны) НЕМЕТАЛЛЫ ТИПЫ СВЯЗИ В ПРОСТЫХ ВЕЩЕСТВАХ МЕТАЛЛИЧЕСКАЯ КОВАЛЕНТНАЯ ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЁТОК ПРОСТЫХ ВЕЩЕСТВ МЕТАЛЛИЧЕСКАЯ МОЛЕКУЛЯРНАЯ ( H2, F2,O2,N2, …) АТОМНАЯ (алмаз, графит) ТИПЫ СВЯЗИ В СЛОЖНЫХ ВЕЩЕСТВАХ МЕТАЛЛ-НЕМЕТАЛЛ ИОННАЯ КОВАЛЕНТНАЯ ПОЛЯРНАЯ (CrO3,Mn2O7) НЕМЕТАЛЛ-НЕМЕТАЛЛ КОВАЛЕНТНАЯ ПОЛЯРНАЯ Типы химической связи ( по природе образования): Металлическая -обобществление электронов внешнего слоя между всеми ионами в кристаллической решётке металла. Li Примеры веществ: (металлы) Na K Ca Al Fe Zn Hg Cu Типы кристаллических решёток по пространственному расположению частиц Ионная (электростатическое притяжение противоположно заряженных ионов). металл + неметалл + большая разница в электроотрицательности NaCl Li•+•F K2 O CaF2 + →Li +[ F ] →LiF Молекулы хлороводорода Ионная кристаллическая решётка Соотношения между разностью электроотрицательностей атомов и ионностью связи в молекулах Разность ЭО атомов 0 Ионность связи, % 0 0,5 1,0 1,5 6 22 43 2,0 2,5 3,0 63 79 89 Температуры плавления и кипения простых веществ, К 2 3 4 6 5 7 8 1 H He 1 20 14 Li 3 1613 454 Na 11 1156 371 K Be 19 Mg Al 12 ≈2725 883 Ca Cu 30 37 Sr Ag 55 942 302 79 21 48 Ga 1179 693 2676 303 38 39 In Au 80 Y 49 56 Tl 1748 576 81 77 63 Zr 15 P 23 V 50 72 33 As 41 2024 601 82 24 51 73 42 1837 545 83 Cl Ar 17 87 84 25 Mn 2235 1517 35 Br 43 52 74 I Po 1235 527 53 W 75 84 536 517 Kr 28 Co 3233 1767 Ni 3173 1728 36 44 45 Rh 46 4000 2236 Ru 4350 2607 Pd 3213 1827 54 165,05 161,3 76 Re 5873 3453 At 27 Fe 3023 1808 Xe 457,5 386,7 5930 3650 18 Tc Mo Te 26 10 120 117 4873 2473 5000 2896 5700 3287 Bi 27 25 332,35 166 1263 723 Ta 85 53 239 172 34 Se Ne 9 Cr Nb Sb F 2953 2163 5033 2750 5673 2503 Pb 718 () 386 958,1 494 1907 903,7 Hf 16 S 3673 2193 4623 2128 Sn 8 90 55 889 (субл) ()1090 40 3730 1194 630 234 32 Ge La* Hg Ti 2543 505,05 57 O 7 3533 1944 3123 1211 2297 429 1910 1000 3153 1338 31 N (белый) 553 317 22 ≈ 3590 1801 Cd 14 Si 3522 1688 Sc Zn 1039 594,2 Ba (алм.) 5100 субл) 3820 3110 1814 1663 1041 2440 1235,08 Cs 20 C 13 1768 1115 960 312 47 5 B 3931 2347 2840 1357 Rb 4 2744 1560 1378 923 1034 337 29 2 4 2 (3,76 Мпа) 85 77 Os 5300 3300 Rn 211 202 Ir ≈ 4650 2720 86 78 Pt 4100 2042 Ковалентная (обобществление двух электронов за счёт перекрывание электронных орбиталей атомов). Примеры веществ: (неметаллы) H2 H-H O2 O=O N2 N≡N F2 F-F Cl2 Cl-Cl Br2 Br-Br I2 I-I Н – Н 436,0 кДж/моль О= О 646,3 кДж/моль N ≡N 945,3 кДж/моль 4,5 эВ 6,7 эВ 9,8 эВ • Энергия связи (Ехс) • Длина связи – расстояние между ядрами атомов, образующих связь • Угол связи • Направленность – соединение атомов между собой при образовании общих электронных пар в определённых направлениях. • Насыщаемость – способность атомов присоединять к себе определённое число других атомов (ограничено валентными возможностями) • Полярность связи – неравномерное распределение электронной плотности между атомами в молекуле. Неспаренные электроны Пара электронов, находящихся на одной орбитали и вакантная орбиталь Энергия разрыва химических связей в некоторых молекулах, кДж/моль Молекула HF HCl HBr HI Энергия связи 568,5 431,6 366,1 298,3 F 9 0,058 (ков.) Cl 17 0,099 (ков.) Br 35 0,119 I 53 0,136 Атомные радиусы, нм ковалентная связь - обобществление электронов с образованием общих электронных пар Н● + ●Н Н Н _ ++ _ + Н● + ●Н + Н Н электронная формула + Формы атомных орбиталей Способы перекрывания атомных орбиталей σ-связь π-связь Способы перекрывания атомных орбиталей Вещество Температура плавления, oC Температура кипения, oC H2O 0,0 100,0 H2S -85,5 -60,7 H2Se -64,8 -41,5 H2Te -49,0 -2,0 HF -83,1 -19,5 HCl -112,0 -84,9 HBr -87,0 -66,8 HI -50,9 -39,4 NaF 993 NaCl 800 NaBr 747 NaI 651 CO -205 CaO 2850 Какая из перечисленных двухатомных молекул имеет наиболее прочную связь? NO CO N2 O2 Какая последовательность является верной для характеристики энергии связи в следующих молекулах: (A) CO2 > CCl4 > N2 > CH4 (B) N2 > CO2 > CCl4 > CH4 (C) CO2 > N2 > CCl4 > CH4 (D) N2 > CO2 > CH4 > CCl4 Энергия разрыва химических связей в некоторых молекулах, кДж/моль Молекула ∆H0298 H2 Li2 B2 C2 N2 O2 F2 Cl2 Br2 I2 HF HCl HBr HI NO CO 436,0 101,7 278 605,0 945,3 498,4 159 239,2 201 151,1 568,5 431,6 366,1 298,3 632 1076,4 1076 кДж/моль Формула H2O H2S H2Se H2Te CO2 CS2 N2O NO2 NO2– O3 OF2 HCN Углы между связями H-O-H 104,5 H-S-H 92 H-Se-H 91 H-Te-H 90,5 O-C-O 180 S-C-S 180 O-N-N 180 O-N-O 134 O-N-O 116 O-O-O 117 F-O-F 103 H-C-N 180 Формула SO2 BF3 BCl3 BBr3 CO32– P4 NH4+ NO3– NH3 PH3 AsH3 SO3 SO32– SO42– ClO3– ClO4– Углы между связями O-S-O F-B-F Cl-B-Cl Br-B-Br O-C-O P-P-P H-N-H O-N-O H-N-H H-P-H H-As-H O-S-O O-S-O O-S-O O-Cl-O O-Cl-O 119 120 120 120 120 60 109 120 107 93 92 120 105 119 106 109 SP гибридизация • форма молекулы – линейная • углы между осями орбиталей равны 1800 SP2 гибридизация SP2 гибридизация • форма молекулы треугольная • углы между осями орбиталей равны 1200 SP3 гибридизация SP3 гибридизация • форма молекулы – тетраэдр • углы между осями орбиталей равны 1090 28/ Формула H2O H2S H2Se H2Te CO2 CS2 N2O NO2 NO2– O3 OF2 HCN Углы между связями H-O-H 104,5 H-S-H 92 H-Se-H 91 H-Te-H 90,5 O-C-O 180 S-C-S 180 O-N-N 180 O-N-O 134 O-N-O 116 O-O-O 117 F-O-F 103 H-C-N 180 Формула SO2 BF3 BCl3 BBr3 CO32– P4 NH4+ NO3– NH3 PH3 AsH3 SO3 SO32– SO42– ClO3– ClO4– Углы между связями O-S-O F-B-F Cl-B-Cl Br-B-Br O-C-O P-P-P H-N-H O-N-O H-N-H H-P-H H-As-H O-S-O O-S-O O-S-O O-Cl-O O-Cl-O 119 120 120 120 120 60 109 120 107 93 92 120 105 119 106 109 Формула H2O H2S H2Se H2Te CO2 CS2 N2O NO2 NO2– O3 OF2 HCN Углы между связями H-O-H 104,5 H-S-H 92 H-Se-H 91 H-Te-H 90,5 O-C-O 180 S-C-S 180 O-N-N 180 O-N-O 134 O-N-O 116 O-O-O 117 F-O-F 103 H-C-N 180 Формула SO2 BF3 BCl3 BBr3 CO32– P4 NH4+ NO3– NH3 PH3 AsH3 SO3 SO32– SO42– ClO3– ClO4– Углы между связями O-S-O F-B-F Cl-B-Cl Br-B-Br O-C-O P-P-P H-N-H O-N-O H-N-H H-P-H H-As-H O-S-O O-S-O O-S-O O-Cl-O O-Cl-O 119 120 120 120 120 60 109 120 107 93 92 120 105 119 106 109 Водородная связь Для образования необходимо наличие в одной молекуле связи Н – сильно электроотрицательный элемент (F,O,N) Примеры: HF, H2O, CH3OH, NH3 Образование межмолекулярной водородной связи. Н Н Н H O:- H+ O:- H+ O: Водородная связь может быть и внутримолекулярной. В частности у белков вторичная структура поддерживается водородными связями.