fermenty 11
реклама

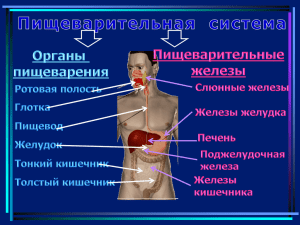
ФЕРМЕНТЫ Ферме́нты, или энзи́мы (от лат. fermentum, греч.ζύμη, ἔνζυμον — закваска) — обычно белковые молекулы или молекул РНК (рибозимы) или их комплексы, ускоряющие (катализирующие) химические реакции в живых системах. Реагенты в реакции, катализируемой ферментами, называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам (АТФаза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу). Ферментативная активность может регулироваться активаторами и ингибиторами (активаторы — повышают, ингибиторы — понижают). Белковые ферменты синтезируются на рибосомах, а РНК — в ядре. Термины «фермент» и «энзим» давно используют как синонимы (первый в основном в русской и немецкой научной литературе, второй — в англо- и франкоязычной). Наука о ферментах называется энзимологией, а не ферментологией (чтобы не смешивать корни слов латинского и греческого языков). ИСТОРИЯ ИЗУЧЕНИЯ Термин фермент предложен в XVII веке химиком ван Гельмонтом при обсуждении механизмов пищеварения. В кон. ХVIII — нач. XIX вв. уже было известно, что мясо переваривается желудочным соком, а крахмал превращается в сахар под действием слюны. Однако механизм этих явлений был неизвестен.В XIX в. Луи Пастер, изучая превращение углеводов в этиловый спирт под действием дрожжей, пришёл к выводу, что этот процесс (брожение) катализируется некой жизненной силой, находящейся в дрожжевых клетках. Более ста лет назад термины фермент и энзим отражали различные точки зрения в теоретическом споре Л. Пастера с одной стороны, и М. Бертло и Ю. Либиха — с другой, о природе спиртового брожения. Собственно ферментами (от ла. fermentum — закваска) называли «организованные ферменты» (то есть сами живые микроорганизмы), а терминэнзим (от греч. ἐν- — в- и ζύμη — дрожжи, закваска) предложен в 1876 году В. Кюне для «неорганизованных ферментов», секретируемых клетками, например, в желудок (пепсин) или кишечник (трипсин, амилаза). Через два года после смерти Л. Пастера в 1897 году Э. Бухнер опубликовал работу «Спиртовое брожение без дрожжевых клеток», в которой экспериментально показал, что бесклеточный дрожжевой сок осуществляет спиртовое брожение так же, как и неразрушенные дрожжевые клетки. В 1907 году за эту работу он был удостоен Нобелевской премии. Впервые высокоочищенный кристаллический фермент (уреаза) был выделен в 1926 году Дж. Самнером. В течение последующих 10 лет было выделено ещё несколько ферментов, и белковая природа ферментов была окончательно доказана. Каталитическая активность РНК впервые была обнаружена в 1980-е годы у прерРНК Томасом Чеком, изучавшим сплайсинг РНК у инфузории Tetrahymena thermophila. Рибозимом оказался участок молекулы пре-рРНК Tetrahymena, кодируемый интроном внехромосомного гена рДНК; этот участок осуществлял аутосплайсинг, то есть сам вырезал себя при созревании рРНК. ФУНКЦИИ ФЕРМЕНТОВ Ферменты присутствуют во всех живых клетках и способствуют превращению одних веществ (субстратов) в другие (продукты). Ферменты выступают в роли катализаторов практически во всех биохимических реакциях, протекающих в живых организмах. К 2013 году было описано более 5000 разных ферментов. Они играют важнейшую роль во всех процессах жизнедеятельности, направляя и регулируя обмен веществ организма. Подобно всем катализаторам, ферменты ускоряют как прямую, так и обратную реакцию, понижая энергию активации процесса. Химическое равновесие при этом не смещается ни в прямую, ни в обратную сторону. Отличительной особенностью ферментов по сравнению с небелковыми катализаторами является их высокая специфичность — константа связывания некоторых субстратов с белком может достигать 10−10 моль/л и менее. Каждая молекула фермента способна выполнять от нескольких тысяч до нескольких миллионов «операций» в секунду. КЛАССИФИКАЦИЯ ФЕРМЕНТОВ Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом: КФ 1: Оксидоредуктазы, катализирующие окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа. КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ. КФ 3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинли паза. КФ 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов. КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата. КФ 6: Лигазы, катализирующие образование химических связей между субстратами за счёт гидролиза АТФ. Пример: ДНК-полимераза. Будучи катализаторами, ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям. МНОЖЕСТВЕННЫЕ ФОРМЫ ФЕРМЕНТОВ Изоферменты — это ферменты, синтез которых кодируется разными генами, у них разная первичная структура и разные свойства, но они катализируют одну и ту же реакцию. Виды изоферментов: Органные — ферменты гликолиза в печени и мышцах. Клеточные — малатдегидрогеназа цитоплазматическая и митохондриальная (ферменты разные, но катализируют одну и ту же реакцию). Гибридные — ферменты с четвертичной структурой, образуются в результате нековалентного связывания отдельных субъединиц (лактатдегидрогеназа — 4 субъединицы 2 типов). Мутантные — образуются в результате единичной мутации гена. Аллоферменты — кодируются разными аллелями одного и того же гена. Собственно множественные формы (истинные) — это ферменты, синтез которых кодируется одним и тем же аллелем одного и того же гена, у них одинаковая первичная структура и свойства, но после синтеза на рибосомах они подвергаются модификации и становятся разными, хотя и катализируют одну и ту же реакцию. Изоферменты разные на генетическом уровне и отличаются от первичной последовательности, а истинные множественные формы становятся разными на посттрансляционном уровне. МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ В основу теории механизма действия ферментов положено образование фермент-субстратного комплекса. Механизм действия фермента, исходя из работ Брауна, Михаэлиса и Ментен можно представить поэтапно: 1. образование фермент-субстратного комплекса (субстрат прикрепляется к активному центру фермента). 2. на второй стадии ферментативного процесса, которая протекает медленно, происходят электронные перестройки в фермент-субстратном комплексе. Фермент (Еп) и субстрат (8) начинают сближаться, чтобы вступить в максимальный контакт и образовать единый ферментсубстратный комплекс. Продолжительность второй стадии зависит от энергии активации субстрата или энергетического барьера данной химической реакции. Энергия активации энергия, необходимая для перевода всех молекул 1 моля 8 в активированное состояние при данной температуре. Для каждой химической реакции существует свой энергетический барьер (см. наглядный материал). Благодаря образованию фермент-субстратного комплекса снижается энергия активации субстрата, реакция начинает протекать на более низком энергетическом уровне. Поэтому вторая стадия процесса лимитирует скорость всего катализа. 3. на третьей стадии происходит сама химическая реакция с образованием продуктов реакции. Третья стадия процесса непродолжительна. В результате реакции субстрат превращается в продукт реакции; фермент-субстратный комплекс распадается и фермент выходит неизмененным из ферментативной реакции. Таким образом, фермент дает возможность за счет образования фермент-субстратного комплекса проходить химической реакции обходным путем на более низком энергетическом уровне. МЕДИЦИНСКОЕ ЗНАЧЕНИЕ Связь между ферментами и наследственными болезнями обмена веществ была впервые установлена А. Гэрродом в 1910-е гг. Гэррод назвал заболевания, связанные с дефектами ферментов, «врожденными ошибками метаболизма». Если происходит мутация в гене, кодирующем определенный фермент, может измениться аминокислотная последовательность фермента. При этом в результате большинства мутаций его каталитическая активность снижается или полностью пропадает. Если организм получает два таких мутантных гена (по одному от каждого из родителей), в организме перестает идти химическая реакция, которую катализирует данный фермент. Например, появление альбиносов связано с прекращением выработки фермента тирозиназы, отвечающего за одну из стадий синтеза темного пигмента меланина. Фенилкетонурия связана с пониженной или отсутствующей активностью фермента фенилаланин-4-гидроксилазы в печени. В настоящее время известны сотни наследственных заболеваний, связанные с дефектами ферментов. Разработаны методы лечения и профилактики многих из таких болезней. ПРАКТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ Ферменты широко используются в народном хозяйстве — пищевой, текстильной промышленности, в фармакологии и медицине. Большинство лекарств влияют на течение ферментативных процессов в организме, запуская или приостанавливая те или иные реакции. Ещё шире область использования ферментов в научных исследованиях и в медицине. СПАСИБО ЗА ВНИМАНИЕ ☻