неметаллы открытый урок
реклама

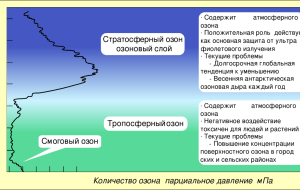
МБОУ Красногорская основная общеобразовательная школа. 9 класс. Учитель химии: Никифорова С.В. Рассмотреть положение неметаллов в ПСХЭ Д.И. Менделеева и особенности их электронного строения; Повторить понятия электроотрицательности (ЭО) и аллотропии; Рассмотреть состав воздуха. Актуализировать знания учащихся о физических свойствах неметаллов, о типах кристаллических решеток, о аллотропии и составе воздуха. Развивать умения применять знания, сравнивать и делать выводы. Воспитывать химическую аккуратность по отношению к окружающей среде. Металлы Большой радиус атома Неметаллы Небольшой радиус атома Небольшое число Число электронов на электронов на внешнем внешнем уровне 4-8 энергетическом уровне (от 1 до 3) Отдают электроны Принимают недостающие электроны Являются Являются восстановителями окислителями По диагонали от B к At и над ней в главных подгруппах ЭО – это способность атомов оттягивать на себя электроны в химическом соединении. Чем больше ЭО элемента, тем сильнее его способность к оттягиванию общих электронных пар, а значит, тем сильнее неметаллические (окислительные) способности. H,As,I,Si,P,Se,C,S,Br,CI,N,O,F Усиление электроотрицательности Газообразные Жидкие Твердые Кислород, водород, озон, фтор, хлор, азот бром Бор, углерод, кремний, фосфор, сера, селен, теллур, йод, астат. Красный фосфор Сера Хлор-желто-зеленый газ Фиолетовые пары йода Неметаллы От 3800 градусов (графит) до – 210 градусов (азот) Металлы От 3380 градусов (ванадий) до – 38,9 градусов (ртуть) Молекулярная O ,O ,N , галогены, белый фосфор 2 3 2 Атомная Алмаз, графит, Si, B Все металлы имеют только металлическую кристаллическую решетку Аллотропия – это явление, при котором один и тот же химический элемент образует несколько простых веществ. Фосфор белый (P4) Имеет молекулярную кристаллическую решетку Фосфор красный Имеет атомную кристаллическую решетку Название от греч. phosphoros светоносный. Белый фосфор - твердое кристаллическое вещество. В обычных условиях фосфор внешне очень похож на воск. На холоде фосфор хрупок, но при комнатной температуре сравнительно мягок и легко режется ножом. . Белый фосфор очень токсичен. Главный потребитель белого фосфора - сельское хозяйство (фосфорные удобрения); применяется в спичечном производстве, металлургии Хранят в очищенной воде Главный потребитель белого фосфора - сельское хозяйство (фосфорные удобрения); При взрыве такого боеприпаса происходит дробление фосфора на куски, которые самовоспламеняются на воздухе, образуя облако белого дыма. При горении образуется фосфорный ангидрид (P2O5), который с влагой воздуха образует белый дым из мельчайших капелек фосфорных кислот. Вызывает сильнейшие ожоги Впервые был получен в 1847 году в Швеции австрийским химиком А. Шрёттером В зависимости от способа получения и степени дробления, красный фосфор имеет оттенки от пурпурно-красного до фиолетового, а в литом состоянии — тёмнофиолетовый с медным оттенком, имеет металлический блеск. Химическая активность красного фосфора значительно ниже, чем у белого; ему присуща исключительно малая растворимость. Кислород O2 Газ, не имеет цвета, вкуса, запаха Озон O3 Газ светлосиний с сильным запахом Озон более сильный окислитель, чем кислород. На этом основано его применение:отбелив ание тканей, дезодорирование (удаление) запахов жиров и масел, обеззараживание воздуха и питьевой воды. Всем хорошо известно как необычно пахнет воздух после грозы. Это запах образующегося во время электрических разрядов озона, который недаром в переводе с греческого означает «пахучий». Характерный запах озона не спутать ни с чем – он пахнет свежестью. Озоновый слой находится от 19 до 35 км над поверхностью Земли. Озон образуется и близко к поверхности Земли во время грозы, при ударе молнии, и в рентгеновском оборудовании. Озон для очистки воды применяется уже более ста лет. Широкое же распространение озон получил только в течение последних 30 лет благодаря появлению надежных, компактных и энергосберегающих аппаратов для его синтеза – озонаторов (генераторов озона). Задерживает губительные ультрафиолетовые лучи, которые разрушительно действуют на клетки живых организмов. Поэтому проблема образования озоновых дыр имеет особое значение. Самая большая озоновая дыра диаметром свыше 1000 км впервые была обнаружена в 1985 году, на Южном полушарии, над Антарктидой. Сначала предполагали, что на озон влияют частицы, выбрасываемые при атомных взрывах; пытались объяснить изменение концентрации озона полетами ракет и высотных самолетов. В конце концов, было четко установлено, что причина нежелательного явления – реакции с озоном некоторых веществ, производимых химическими заводами Промышленные заводы Транспорт Аэрозоли Чтобы начать глобальное восстановление нужно уменьшить доступ в атмосферу всех веществ, которые очень быстро уничтожают озон и долго там хранятся. Также мы - все люди, должны это понимать и помочь природе включить процесс восстановления озонового слоя, нужны новые посадки лесов. А. Лавуазье XVIII век Воздух N2 4/5 объема воздуха O2 1/5 объема воздуха Постоянные Переменные N2, O2, CO2 – 0,03%, благородные водяные газы пары, озон Случайные Пыль, микроорганизмы, пыльца растений, оксиды серы и азота, которые вызывают кислотные дожди Под термином «кислотный дождь» подразумеваются различные метеорологические осадки (дождь, град, снег, дождь со снегом, туман), при которых наблюдается значительное понижение уровня ph. Загрязняющие вещества, которые и приводят к возникновению кислотных дождей, выбрасываются в атмосферу в результате работы тепловых электростанций, металлургических предприятий, автомобильным транспортом и др. Затем эти вредные вещества выпадают на землю вместе с дождем, снегом или другими метеорологическими осадками, с которыми у них произошла реакция. Кислотный дождь отрицательно воздействует на водоемы, он повышает в них кислотность до такого уровня, что в водоемах погибает фауна и флора. Кислотные дожди могут вызывать у человека заболевания дыхательных путей. Независимо от того, как вредные вещества, переносимые кислотным дождем, попадут в организм (через еду, питье или воздух), последствием может стать не только тяжелое заболевание, но и летальный исход, причем это касается как взрослых, так и детей. Воздух, свободный от переменных и случайных составных частей, прозрачен, лишен цвета, вкуса и запаха. Молярная масса воздуха – 29 г/моль. Дыхание Фотосинтез Выветривание (разрушение) горных пород Почвообразование Минерализация органических веществ п. 15 пересказ №4