13x742
реклама

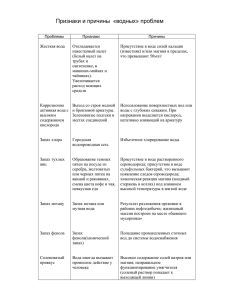
«НАБЛЮДАЯ ЗА ВОДОЙ, ЧЕЛОВЕК МОЖЕТ УЗНАТЬ ТАК МНОГО». НИКОЛАС СПАРКС 13x742 «Зигзаг удачи», МОУ Брейтовская СОШ, 2013 Состав молекул воды Молекулярная формула воды Н2О Качественный состав. Молекула воды состоит из двух химических элементов: водорода и кислорода. Вода - это сложное вещество. Количественный состав: на 2 атома водорода приходится 1 атом кислорода. На фотографиях представлены соответственно шаростержневая и масштабная модели молекулы воды Химическая связь в молекуле воды В молекуле воды ковалентная полярная связь, так как связаны атомы неметаллов с разной электроотрицательностью. Электронная плотность сосредоточена на атоме кислорода, который получил частично отрицательный заряд. Схема образования связи: Н + О + Н = Н :О: Н Н О Н δ+ δ- δ+ Строение молекулы воды Форма молекулы воды определяется sр3 гибридизацией электронных орбиталей атома кислорода. При этом две неподеленные электронные пары кислорода вызывают отклонение угла связи до 104,5 0С. Форма молекулы угловая. Угол образования связи. Перекрывание орбиталей в молекуле воды. Водородные связи между молекулами воды Так как атомы в молекуле лежат не на одной линии, то противоположные заряды не гасят друг друга и молекула воды становится диполем. Между атомами сильно электроотрицательного элемента и электроположительными атомами водорода образуются слабые водородные связи. Они оказывают значительное влияние на физические свойства воды, повышая ее температуры плавления и кипения, в результате вода является жидкостью (н.у.) Температура плавления твердой воды 00с, а температура кипения 100 0С. (фото внизу) Особые физические свойства, определяемые ее строением Высокое поверхностное натяжение воды позволяет металлическому лезвию держаться на поверхности. Этим свойством жидкой воды пользуются водомерки и др. насекомые. Аномально, но плотность льда меньше плотности воды. Доказательство – лед плавает на поверхности. Благодаря пустотам в кристаллической решетке плотность льда меньше 1 и равна 0,92 г/см3. Роль диполей воды в диссоциации Полярные молекулы воды (диполи) являются причиной диссоциации электролитов. Противоположными полюсами диполи воды прикрепляются к ионам (гидратация) и вызывают разрушение кристаллической решетки. В результате водные растворы многих веществ являются проводниками тока. Чистая вода (дистиллированная) не является электролитом. Механизм диссоциации веществ с ионной кристаллической решеткой. Результат диссоциации – гидратированные ионы. Доказательства гидратации веществ Вода вступает в химическую реакцию с растворимыми в ней веществами. Этот процесс называют гидратацией. Доказательством служат тепловые явления при смешивании веществ с водой. Начальная температура воды 200С. При добавлении даже разбавленной серной кислоты наблюдается значительное выделение теплоты, вода нагревается до 300С. Выводы Вода – сложное вещество молекулярного строения. Форма молекулы угловая. Молекула воды является диполем, так как сильно поляризована. В молекулах воды связь ковалентная полярная, а между молекулами – водородная. Вода обладает особыми физическими свойствами, определяемыми особенностями ее строения (повышенные температуры плавления и кипения, поверхностное натяжение, высокая теплоемкость, уменьшение плотности при замерзании и др.) Цель и задачи исследования Цель: Сравнить свойства воды, взятой из природных источников, со свойствами дистиллированной воды, подтвердить теоретические сведения практикой. Определить свойства воды органолептическим способом (запах, прозрачность, цвет); Определить свойства воды с помощью физических приборов (аэрометра); Определить состав воды с помощью качественных реакций; Сформулировать выводы по результатам эксперимента. Исследование свойств воды Для исследования и сравнения свойств мы выбрали воду трех источников: Дистиллированную Водопроводную Талую (снеговую) (снег свежевыпавший) Определение цветности (цвета) воды Цвет воды сравнивают на листе белой бумаги. Мы обнаружили, что дистиллированная и талая воды практически бесцветны, в отличии от водопроводной воды, имеющей желтоватый оттенок. Определение запаха воды Анализ проводили при комнатной температуре и при нагревании воды до 50-60 0С 100 мл каждой воды заливали в колбу , закрывали пробкой и встряхивали 5-10 секунд. Затем вынимали пробку и определяли запах с помощью обоняния. Интенсивность запаха определяли по шкале (1-5 баллов). Результаты определения запаха Вода Характер запаха Интенсивность запаха Дистиллированна я Запах отсутствует 0б -Отсутствие ощутимого запаха Водопроводная Металлический запах 2б - Запах слабый, не привлекающий внимания Талая Прелый запах 2б - Запах слабый, не привлекающий внимания Запахи делятся на естественные (например запах грунта в талой воде) и искусственные (запах металлических труб в водопроводной воде). Определение прозрачности (мутности) воды Сравнивали прозрачность воды с помощью плоского цилиндра, поставленного на печатный шрифт с высотой букв 2мм. Измеряли высоту столбика воды, при которой текст остается читаемым. Определение прозрачности (мутности) воды Вода Высота столбца воды в цилиндре Прозрачность (мутность) Дистиллированная Более 22 см прозрачная Талая 19 см прозрачная Водопроводная 14см слабо мутная Определение плотности воды Определение плотности воды проводили лабораторным аэрометром. Результаты замеров получили примерно одинаковые (1000 кг/м3 или 1г/см3). Содержание солей в талой и водопроводной воде незначительно, поэтому разница в величине плотности не заметна (или для ее определения нужен более точный прибор). Аэрометр Водопроводная вода Дистиллированная Талая вода Определение значения рН воды Для определения рН воды использовали как универсальную индикаторную бумагу (верхний рисунок), так и лакмусовую разного цвета. Цвет лакмуса не изменился, что говорит о нейтральной среде. А универсальный индикатор показывает слабокислую среду. Отклонение от нормы незначительное. Определение хлоридов в воде Для обнаружения ионов хлора в пробирки отбирали по 5 мл воды и добавляют 3 капли 10%-го раствора нитрата серебра, подкисленного азотной кислотой. Содержание хлоридов определяли визуально по помутнению или появлению осадка хлорида серебра белого цвета. Cl- + Ag+ = AgCl Слева направо: водопроводная, дистиллированная, талая вода. Небольшое помутнение указывает на наличие солей хлора (1-10 мг/л ) в природной воде. Дистиллированная вода не содержит примесей. Обнаружение ионов марганца в воде В каждую пробу воды добавили розовый раствор перманганата калия. Сравнили изменения, происходящие через некоторое время. Растворенные в воде соединения марганца окисляется с образованием малорастворимого оксида марганца (осадок бурого цвета)согласно следующему уравнению: 3 Mn2+ + 2 KMnO4 + 2 H2O = 5 MnO2↓ + 4 H+ Результаты опыта через 10 и 60 минут. Повышенное содержание ионов марганца в водопроводной (левая пробирка) и наличие этих ионов в талой (правая пробирка) воде. Определение железа в воде К 5 мл воды прибавили 1-2 капли концентрированной соляной кислоты и 5 капель 10%-ного раствора роданида калия. В присутствии ионов трехвалентного железа образуется роданид железа (III) красного цвета. Едва заметное розовое окрашивание в левой пробирке (водопроводная вода 0,4-0,95 мг/л), красное пятно в правой пробирке (талая вода 1-3 мг/л). Дистиллированная вода не содержит растворимых солей. Результаты исследования Дистиллированная вода бесцветна, прозрачна, не имеет запаха. Она не содержит растворенных солей. Природные воды разных источников могут отличаться прозрачностью, запахом, значением рН, так как содержат разное количество растворенных солей. Эти соли придают им разную окраску. В исследуемой водопроводной воде выявлено наличие ионов хлора, марганца и железа в допустимых, но заметных количествах. Талая вода, полученная из только что выпавшего снега, оказалась чистой и прозрачной. Но в ней тоже присутствуют хлориды, соединения марганца и значительное количество соединений железа (III). Этапы урока для 8-классников Представление теоретических вопросов Изложение результатов эксперимента с демонстрацией некоторых опытов Этап проверки знаний Учащиеся отвечают на вопросы теста Обработка результатов теста Ответы учащихся занесены в таблицу и проанализирован уровень усвоения материала Таблица результатов № п/п учащегося Количество набранных баллов Итого +балло в (В) % выполнения (А/В)*100% Задание №1 (1б) Задание №2 (1б) Задание №3 (1б) Задание №4 (1б) Задание №5 (3б) 1 - + + + + 6б 85,7% 2 + + + + + 7б 100% 3 + + + + + 7б 100% 4 + + + + + 7б 100% 5 + - + + + 6б 85,7% 6 + + + + - 4б 57% 7 + + + + + 7б 100% 8 + + + + + 7б 100% 9 + + + + + 7б 100% 10 + + + + + 7б 100% 11 + + + + - 4б 57% 12 + + + + + 7б 100% 13 + + + + + 7б 100% 14 + + + + + 7б 100% 15 + + + + + 7б 100% 16 + + + + + 7б 100% 17 + + + + + 7б 100% 94% 94% 100% 100% 88% 6,53б 93,5% +Общий процент выполнения тестовых заданий учащимися Вопрос первый 1. 2. 3. 4. Вид химической связи в молекуле воды: Ковалентная неполярная Ионная Ковалентная полярная Водородная Вопрос второй Форма молекулы воды: 1. Линейная 2. Угловая 3. Треугольная 4. Тетраэдрическая Третий вопрос Плотность твердой воды (льда): 1. Меньше плотности жидкой воды 2. Больше плотности жидкой воды 3. Равна плотности жидкой воды Четвертый вопрос Какое из высказываний о дистиллированной воде истинно: 1. Это природная вода 2. Это совершенно чистая вода 3. Она содержит незначительное количество растворенных солей 4. В этой воде было обнаружено много солей железа Пятый вопрос Соотнесите вид исследованной воды с ее описанием А. Водопроводная вода Б. Дистиллированная вода В. Талая вода 1. 2. 3. Прозрачная, без запаха, без содержания солей Желтоватого оттенка, с металлическим запахом, содержит ионы Cl- , Mn 2+ ,Fe3+ Прозрачная, с прелым запахом, содержит много ионов Fe3+ Результаты тестирования В тестировании участвовало 17 учащихся 8 «Б» класса. Количество правильных ответов: 1 вопрос: ответов 16 ( 94%) 2 вопрос: ответов 16 (94 %) 3 вопрос: ответов 17 (100 %) 4 вопрос: ответов 17 (100 %) 5 вопрос: ответов 15 ( 88%) Наиболее сложным оказался вопрос 5 (тестсоответствие) Диаграмма ответов учащихся % выполнения теста 102 100 100 100 98 96 94 94 94 92 % выполнения теста 90 88 88 86 84 82 1 2 3 Номер вопроса теста 4 5 Оценка учителя Молодцы! Постарались: в теории разобрались, схемы нарисовали, исследование провели, выступление и вопросы теста подготовили! Главное, что самим было интересно, поэтому и других сумели заинтересовать. Источники информации 1. 2. 3. 4. Габриелян О.С. Химия 8 класс. Учебник для общеобразовательных учреждений. М.: «Дрофа», 2009 Габриелян О.С., Лысова Г.Г. Химия 11 класс. Учебник для общеобразовательных учреждений. М.: «Дрофа», 2002 Дружинин С.В. Исследование воды и водоемов в условиях школы. М.: «Чистые пруды», 2008 /Библиотека «Первого сентября», Серия «Биология», выпуск 20 http://www.meddr.ru/rukovodstvo_k_prakticheskim_zanyatiyam_p o_me/issledovanie_vody/11125.html