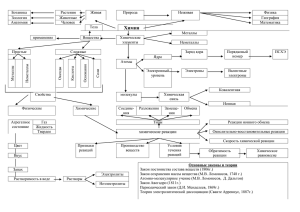
основные классы неорганических веществ
реклама

Учитель химии первой квалификационной категории Жарких Марина Валерьевна МОУ «Ивановская средняя общеобразовательная школа» Стаж работы 23 лет Мало знать, надо и применять. Мало хотеть, надо и делать. Гёте ВЕЩЕСТВА ПРОСТЫЕ МЕТАЛЛЫ НЕМЕТАЛЛЫ СЛОЖНЫЕ ЗАДАНИЕ №1 ДАНЫ СЛЕДУЮЩИЕ ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ: Cu, Hg, S, Fe, N, O, Li, Ca, P, Pb, Cl, H, Ag. Найдите среди них металлы и неметаллы ВЕЩЕСТВА ПРОСТЫЕ МЕТАЛЛЫ НЕМЕТАЛЛЫ СЛОЖНЫЕ оксиды ЗАДАНИЕ №2 ДАНЫ СЛЕДУЮЩИЕ ОКСИДЫ: N2O5, Cl2O7, MgO, CrO3, FeO, Li2O Найдите среди них кислотные и основные ВЕЩЕСТВА ПРОСТЫЕ МЕТАЛЛЫ НЕМЕТАЛЛЫ СЛОЖНЫЕ оксиды основания кислоты Любовный треугольник Лакмус был страстно влюблен в Кислоту и в ее присутствии всегда краснел, а ревнивая Щелочь, которая была к нему неравнодушна, раздражала Лакмуса до посинения. Несчастный Фенолфталеин тайно питал нежные чувства к Щелочи, но, зная её едкий характер, при малейшем к ней прикосновении весь становился малиновым. О каких химических явлениях идет речь? Цель: распознать растворы кислоты и щелочи Инструкция 1. Из пробирки №1 отлить 2 мл. раствора в пустую пробирку №1 (техника безопасности!) 2. В последнюю опустить универсальный индикатор. 3. Сделать вывод. 4. Из пробирки №2 отлить 2 мл. раствора в пустую пробирку №2 (техника безопасности!) 5. В последнюю опустить универсальный индикатор. 6. Сделать вывод. 7 . Из пробирки №2 отлить 2 мл. раствора в пустую пробирку №2 (техника безопасности!) 8. В последнюю добавить кусочек цинка. Что наблюдаете? 9. Напишите уравнение реакции, сделайте вывод. 10. Результаты работы занесите в таблицу. Цель: получить нерастворимое основание Инструкция 1. Закончить уравнение реакции CuSO4 + . . . → Cu(OH)2 ↓ + . . . 2. Из пробирки №3 отлить 2 мл. сульфата меди в пустую пробирку №3 (техника безопасности) 3. В последнюю прилить небольшое количество щелочи из пробирки №1 4. Сделать вывод, результат занести в таблицу,. ВЕЩЕСТВА ПРОСТЫЕ МЕТАЛЛЫ НЕМЕТАЛЛЫ СЛОЖНЫЕ оксиды основания кислоты соли Осуществить превращение C→CO2→H2CO3 Ba→BaO→Ba(OH)2 . . . + H2O Использованные ресурсы: 1. Г.Е. Рудзитис Химия 8 класс, Москва «Просвещение» 2009г. 2. Л.С. Гузей, В.В. Сорокин, Р.П. Суровцева, Химия 8 класс, Москва «Дрофа» 2000г. 3. Е. П. Сгибнева, А.В. Скачкова Современные открытые уроки химии 8-9 класс Ростов-на-Дону «Феникс» 2002 г.