ОСНОВАНИЯ Тема урока Куриленко Н. Н. учитель химии ХЗОШ №145
реклама

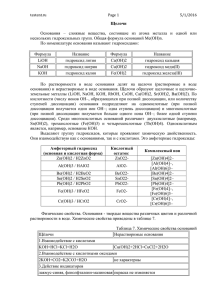
Тема урока ОСНОВАНИЯ Куриленко Н. Н. учитель химии ХЗОШ №145 BaO P2O5 KOH HCl Mg(OH)2 H2SO4 LiOH NaCl H2O Fe(OH)3 Ca(OH)2 MgOHCl Ba(OH)2 K2O Al(OH)3 NO AgNO3 CaO Al2O3 Основания - это сложные вещества, состоящие из атомов металлов и гидроксильных групп ОН. Me(OH)n n = валентность металла Названия оснований КОН Mg(OH)2 LiOH Fe(OH)3 Ca(OH)2 Al(OH)3 калия магния лития железа (III) кальция алюминия гидроксид гидроксид гидроксид гидроксид гидроксид гидроксид Классификация оснований Основания Растворимые (Щелочи) Нерастворимые BaO P2O5 KOH HCl Mg(OH)2 H2SO4 LiOH NaCl H2O Fe(OH)3 Ca(OH)2 MgOHCl Ba(OH)2 K2O Al(OH)3 NO AgNO3 CaO Al2O3 Щелочи Нерастворимые основания KOH LiOH Ca(OH)2 Mg(OH)2 Fe(OH)3 Al(OH)3 Физические свойства оснований Ba(OH)2 Ca(OH)2 LiOH NaOH Cu(OH)2 Co(OH)2 Получение оснований Получение оснований растворимых 1. Активный металл + вода = = щелочь + водород нерастворимых 1. Соль (в растворе)+ щелочь = = нерастворимое основание + + другая соль 2Na + 2H2O = 2NaOH + H2 2. Оксид активного металла + + вода = щелочь CaO + H2O = Ca(OH)2 FeCl3 + 3NaOH = Fe(OH)3 + + 3NaCl Химические свойства щелочей • Действие щелочей на индикаторы лакмус метилоранж фенолфталеин Химические свойства оснований 1. Взаимодействие с кислотами: NaOH + HCl = NaCl +H2O 2. Взаимодействие щелочей с кислотными оксидами: 2NaOH + SO3 = Na2SO4 + H2O 3. Разложение нерастворимых оснований при нагревании: Cu(OH)2 = CuO + H2O Применение Формула основания NaOH КОН Са(ОН)2 Mg(OH)2 Al(OH)3 Применение Домашнее задание §11, упр.4 стр. 55.