Урок железо5.0 МБ
реклама

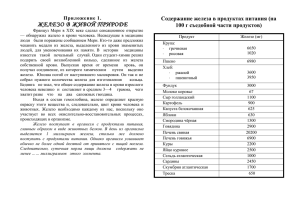
Урок по химии «Железо строение и свойства» Кудрявцева Марина Валентиновна учитель химии МОУ « СОШ № 33» г. Тверь Цель урока: Обеспечить формирование умений: характеризовать железо как элемент и простое вещество, прогнозировать химические свойства, составлять УХР и объяснять их сущность, перечислять области применения железа, развивать логическое мышление, память Актуализация знаний Игра «Да-нет » • Металлы находятся в ПСХЭ в правом верхнем углу? • У металлов на ВЭУ от1 до 3 электронов? • Атомы металлов являются окислителями? • Алюминий щелочной металл? • Металлы имеют ионные кристаллические решетки? • Электрометаллургия- это получение металлов с помощью электрического тока для активных металлов? НОВЫЙ МАТЕРИАЛ Среди металлов самый главный, Важнейший, древний элемент В тяжелой индустрии славный, Знаком с ним школьник и студент. Родился в огненной стихии, Расплав его течет рекой. Важнее нет в металлургии Он нужен всей стране родной. ЖЕЛЕЗО Железо строение и свойства План урока: • Положение железа в ПСХЭ Д.И.Менделеева и строение атома • Нахождение в природе и физические свойства • Химические свойства • Применение Положение железа в ПСХЭ и строение атома Химический элемент 4 периода, 8 группы побочной подгруппы Нахождение в природе • В свободном виде железо встречается в метеоритах, в земной коре 4,1% от массы. • В виде соединений: оксидов, сульфидов, минералах • В водах минеральных источников Fe(HCO3) • В живой природе железо имеет большое значение. Оно участвует в переносе кислорода, участвует в процессе фотосинтеза и дыхании растений. • Является важной составной частью гемоглобина крови Нахождение в природе Красный железняк Fe2O3 Бурый железняк 2Fe2O3 *3H2O Шпатовый железняк FeCO3 Магнитный железняк Fe3O4 Физические свойства: Железо – серебристо-белый металл, сравнительно мягкий, ковкий, пластичный. Обладает ферромагнитными свойствами при температуре ниже 770 0С Температура плавления 1535 0С Температура кипения 2800 0С Действие магнитом Как ты думаешь, оба ли вещества притягиваются магнитом? Железо Алюминий Химические свойства Металл средней активности - восстановитель 1. при нагревании : горит в кислороде 3 Fe + 2 O2 =Fe3 O4 с хлором 2Fe + 3 Cl2 = 2FeCl3 с серой Fe + S = FeS с водой 3Fe +4H2O= Fe2O3*FeO + 4H2 2.без нагревания : Железо вытесняет из растворов солей металлы, находящиеся в электрохимическом ряду напряжений правее железа: Fe + CuSO4 = FeSO4 + Cu С разбавленными кислотами ( серной и соляной) железо реагирует с образованием солей железа(II): Fe + 2HCl = FeCl2 + H2 Fe + H2SO4 = FeSO4 + H2 С кислородом во влажном воздухеобразование ржавчины Fe+O2+H2O=Fe2O3*nH2O Применение железа Закрепление знаний 1. Осуществить цепочку превращений: Fe Fe2O3 X 2. Задача: стр 83№ 6 Учебник Fe2(SO4)3 Домашнее задание Параграф 14,стр 82 №5 Источники информации: Учебник « Химия 9 класс» для общеобразовательных учреждений. О.С.Габриелян. Дрофа 2012 год. Картинки Hppt://900 igr.net/ kartinki –yandex Hppt://mages.yandex www/chem100.ru/eiement Видеоопыты: Yandex/chemistru-chemistri.com