Растворы 8 класс
advertisement

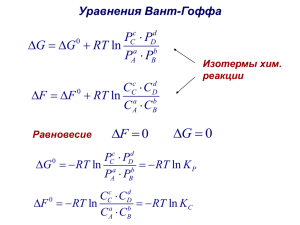
Тема урока: «Растворение. Растворимость веществ в воде.» Знания составляются из мелких крупинок ежедневного опыта (Д.И. Писарев) Цели урока: Познакомится с растворением как физико-химическим процессом и с растворами как физико-химическими системами. Познакомится классификацией растворов по признаку растворимости. Проверка пройденного материала Фронтальный опрос 1. Чем отличается друг от друга обратимые и необратимые реакции? 2. В чем заключается сущность правила Бертолле? 3. Что означает понятие «химическое равновесие» и когда оно наступает? 4. В чем заключается сущность принципа Ле – Шаталье? 5. От каких условий зависит химическое равновесие? Упражнение: Определите тип химической реакции? Как нужно изменить условия реакции для смещения химического равновесия вправо: 2SO2 +O2 kat 2SO3 +Q Объяснение нового материала Растворение. Растворы Физическая теория Химическая теория (Вант-Гофф, Ост(Менделеев, Каблуков, вальд, Аррениус). Кистяковский). Растворение –это Растворение –это процесс процесс диффузии, химического взаимодействия а растворы – это растворяемого вещества с однородные смеси водой – процесс гидратации, а соединения - гидраты растворы – это соединения гидраты Современная теория Растворение – это физико-химический процесс, а растворы – это однородная (гомогенная) система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия – гидратов непостоянный постоянный состав в состав в кристаллогидратах растворах (CuSO4 *5H2O,Na2 SO4 *10H2O) Признаки химического взаимодействия при растворении Тепловые явления Экзотермические (растворение H2 SO4, NaOH) Эндотермические (растворение NH4NO3, NaCL) Изменение цвета Белые кристаллы дальнейшее CuSO4 выпаривание (безводного) Синие кристаллы CuSO4 *5H2O, (раствор голубого цвета) прилипание H2O Факторы, от которых зависит растворимость твердых веществ От природы веществ(на 1г. H2O при 20C ) Хорошо растворимые Практически нерастворимые ( более 1г.) (меньше 0,01г.) Малорастворимые Р Н (менее 1 г.) М От температуры Типы растворов по содержанию растворенного вещества Типы растворов Ненасыщенные - Насыщенныевещество при больше не данной темпера- растворяется туре еще растворяется Перенасыщенныесодержит в растворе больше вещества, чем насыщенный раствор Закрепление нового материала задание №7 на 142 странице РЕШЕНИЕ ЗАДАЧИ Дано: m( p-pa) =500г. t(растворения) =20С Найти m(осадка) Решение MgSO4 +BaCL2 = BaSO4+MgCL2 Если при20 С в100г. р-ра -38г. р.в то в 500г. р-ра –х г. р.в хг. = 500*38: 100= 190г. М(BaSO4)=137+32+16*4=233г./моль М(MgSO4)= 24+32+16*4= 120г./моль 190г. = хг 120г. 233г. Х = 190* 233:120=369г. ответ: m(BaSO4)=369г. Домашняя работа параграф 34 стр.136 – 142 упражнение 5 стр.142