8 класс Пономарева Н.А. МБОУ «Лицей № 56» Ростов-на-Дону
реклама

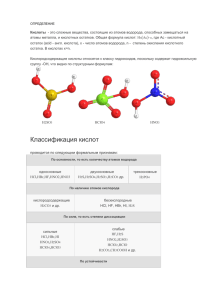
8 класс Пономарева Н.А. МБОУ «Лицей № 56» Ростов-на-Дону Определение Кислотами называют сложные вещества , состоящие из кислотных остатков и водорода, который может замещаться на атомы металлов. H An Кислоты Название кислоты Формула кислоты Валентность остатка Название соли Соляная кислота HCl I Хлориды Серная кислота H2SO4 II Сульфаты Азотная кислота HNO3 I Нитраты Ортофосфорная кислота H3PO4 III Ортофосфаты Сероводородная кислота H2 S II Сульфиды Угольная кислота H2CO3 II Карбонаты Йодоводородная кислота HI I Йодиды Классификация кислот по составу кислотного остатка кислородосодержащие H2SO4 H3PO4 H2CO3 бескислородные HCl HBr H2S Классификация кислот по основности oдноосновные HCl HBr HI двухосновные H2S H2CO3 H2SO4 трехосновные H3PO4 H3BO3 Структурные формулы кислот HCl H2S H - Cl H H2SO4 H H–O S S H–O соляная кислота сероводородная кислота O O серная кислота Получение кислот 1. бескислородных H2 + M → H An H2 + Cl2 → 2 HCl водород хлор хлороводород (р-р соляная кислота) водород + неметалл = кислота H2 + S → H2S водород сера сероводород (р-р сероводородная кислота) Получение кислот 2. кислородосодержащих а) H2O + MO → H An вода + кислотный оксид = кислота H2O + SO3 → H2SO4 H2O + CO2 → H2CO3 вода вода оксид серы (VI) серная кислота оксид углерода (IV) угольная кислота Получение кислот 2. кислородосодержащих б) соль слабой + сильная = соль сильной кислоты кислота M An1 + H An2 = кислоты M An2 + слабая кислота + HAn1 Na2S + 2HCl → 2NaCl + H2S↑ сульфид натрия соляная кислота хлорид натрия сероводородная к-та Домашнее задание § 32, с. 100-101 , с. 102 схема 16 Свойства кислот Применение Физические свойства кислот Химические свойства кислот 1. Изменение цвета индикатора. индикатор нейтральная среда кислая среда лакмус фиолетовый красный фенолфталеин бесцветный бесцветный метиловый оранжевый оранжевый розовый Химические свойства кислот 2. с металлами (ряд Бекетова Н.Н.) Mg + 2 HCl → MgCl2 + H2 ↑ Zn + 2 HCl → ZnCl2 + H2 ↑ Cu + HCl → Химические свойства кислот 3. С основными оксидами t CuO + 2HCl → CuCl2 + H2O 4. Со щелочами NaOH + HCl → NaCl + H2O Химические свойства кислот 5. нерастворимыми основаниями Сu(OH)2↓ + 2HCl → CuCl2 + 2H2O 6. с солями слабых кислот CO2 ↑ CaCO3 + 2HCl → CaCl2 + H2CO3 H2 O Химические свойства кислот 7. разложение t H2SO3 → H2O + SO2 ↑ t H2SiO3 ↓ → H2O + SiO2 ↓ ТБ при работе с кислотами Домашнее задание § 32, с. 101-104 , упр. 8 уравнения № 1,2,8, 10,11