kisloty (format DOC / 80 КБ )
реклама
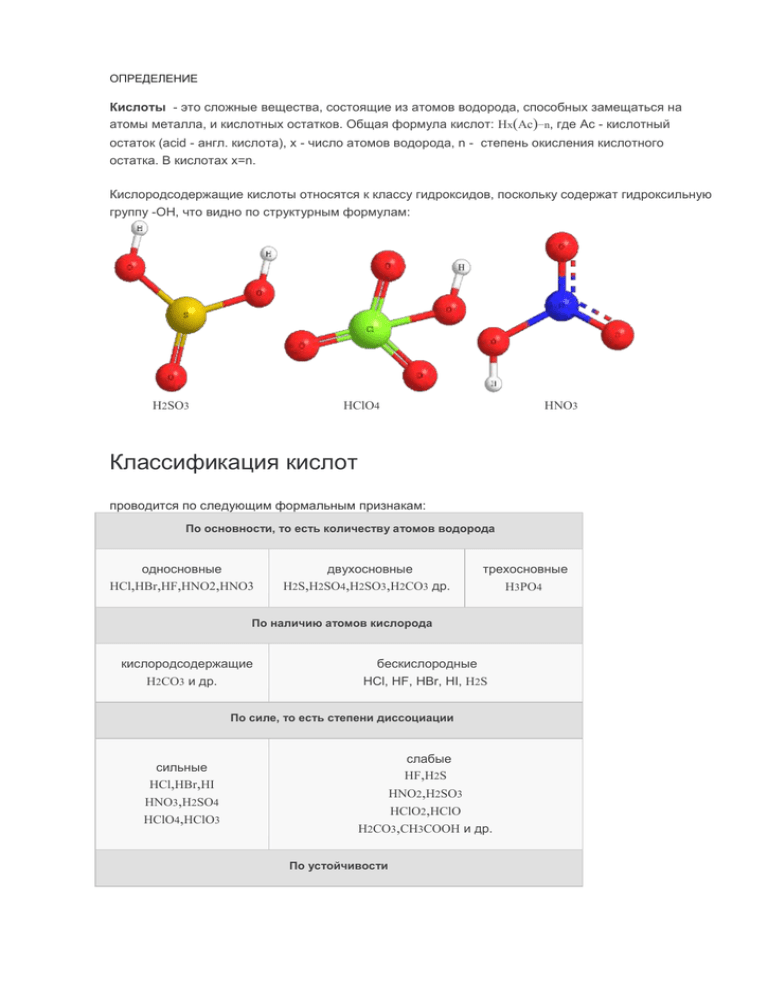
ОПРЕДЕЛЕНИЕ Кислоты - это сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных остатков. Общая формула кислот: Hx(Ac)−n, где Ac - кислотный остаток (acid - англ. кислота), х - число атомов водорода, n - степень окисления кислотного остатка. В кислотах x=n. Кислородсодержащие кислоты относятся к классу гидроксидов, поскольку содержат гидроксильную группу -ОН, что видно по структурным формулам: H2SO3 HClO4 HNO3 Классификация кислот проводится по следующим формальным признакам: По основности, то есть количеству атомов водорода односновные HCl,HBr,HF,HNO2,HNO3 двухосновные H2S,H2SO4,H2SO3,H2CO3 др. трехосновные H3PO4 По наличию атомов кислорода кислородсодержащие H2CO3 и др. бескислородные HCl, HF, HBr, HI, H2S По силе, то есть степени диссоциации слабые HF,H2S сильные HCl,HBr,HI HNO2,H2SO3 HNO3,H2SO4 HClO4,HClO3 HClO2,HClO H2CO3,CH3COOH и др. По устойчивости устойчивые H2SO4и др. неустойчивые только H2CO3,H2SO3 По принадлежности к классам химических соединений неорганические HBr,H3PO4,H2SO4 и др. органические HCOOH,CH3COOH По летучести летучие HNO3,H2S,HCl нелетучие H2SO4 и др. По растворимости в воде растворимые H2SO4 и др. нерастворимые только H2SiO3 Номенклатура кислот Названия бескислородных кислот образуются от названия элемента с суффиксом -о и прибавлением слов «водородная кислота»: HF – фтороводородная; HCl – хлороводородная, H2S – сероводородная. Названия кислородосодержащих кислот строятся следующим образом: название элемента+суффикс(ная, овая, истая и пр.) кислота. Суффикс -ная, -вая характерен для кислот, содержащих элемент в высшей степени окисления. По мере понижения степени окисления суффиксы меняются в следующем порядке: -оватая, -истая, оватистая. Например, H2S+6O4 — серная кислота, но H2S+4O3 сернистая кислота HCl+7O4 — хлорная кислота, HCl+5O3 — хлорноватая кислота, HCl+3O2 — хлористая кислота, HCl+1O - хлорноватистая кислота. Если элемент в одной и той же степени окисления образует несколько кислородсодержащих кислот, то к названию кислоты с меньшим содержанием кислородных атомов добавляется приставка мета-, при наибольшем числе – приставкаорто-. Например, HPO3 метафосфорная кислота и H3PO4 ортофосфорная кислота. Для многих неорганических кислот характерны тривиальные названия: плавиковая кислота - HF или фтороводородная синимальная кислота - HCN или циановодородная соляная кислота - HCl или хлороводородная Название кислоты формула кислоты кислотный остаток и его валентнос ть название солей ангидрид кислоты примеры солей Плавиковая (фтороводородна я) HF −F фторид NaF,MgF2,AlF3 - Соляная (хлороводородна я) HCl −Cl хлорид NaCl,MgCl2,AlCl3 - HBr −Br бромид NaBr,MgBr2,AlBr3 - Йодоводородная HI −I йодид NaI,MgI2,AlI3 - Серная H2SO4 =SO4 сульфат Na2SO4,MgSO4, Al2(SO4)3 SO3 Сернистая H2SO3 =SO3 сульфит Na2SO3,MgSO3 SO2 Сероводородная H2 S =S сульфид Na2S,MgS,Al2S3 - Азотная HNO3 −NO3 нитрат NaNO3,Mg(NO3)2, Al(NO33 N2 O5 Азотистая HNO2 −NO2 нитрит NaNO2,Mg(NO2)2 N2 O3 Фосфорная (ортофосфорная) H3PO4 ≡PO4 фосфат (ортофосфат) Na3PO4,Mg3(PO4)2 ,Al(PO4) P2O5 Угольная H2CO3 =СO3 карбонат Na2CO3,MgCO3 CO2 Кремниевая H2SiO3 =SiO3 силикат Na2SiO3,MgSiO3 SiO2 Марганцевая HMnO4 −MnO4 перманганат NaMnO4,Mg(MnO4) Mn2O7 Двухромовая H2Cr2O7 =Cr2O7 дихромат Na2Cr2O7,MgCr2O7 HCN −CN цианид NaCN,Mg(CN)2 Бромоводороная 2 Синильная (циановодородна я) CrO3


