Соединения железа - Сайт учителя химии Леднёвой Дарьи
advertisement

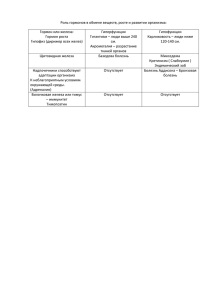
Химия 9 класс Леднева Дарья Николаевна Учитель химии МБОУ СОШ п. Дружба Химические свойства железа Железо, отдавая два внешних электрона, проявляет степень окисления +2; отдавая три электрона (два внешних и один сверхоктетный с предпоследнего энергетического уровня), проявляет степень окисления +3. Fe-2e=Fe+2 Fe-3e=Fe+3 Электронные структуры 3d- и 4s-орбиталей атома железа и ионов Fe+2 и Fe+3 можно изобразить так: Металл средней активности Химические свойства 3Fe + 2O2 = Fe3O4 2Fe + 3Cl2 = 2FeCl3 Fe + 2HCl = FeCl2 + H2 Fe + S = FeS Fe + CuSO4 = FeSO4 + Cu Разобрать уравнение с окислительновосстановительной точки зрения Fe + O2 + H2O = Fe(OH)3 Оксиды железа Название Формула Свойства Характер Оксид железа (II) FeO Тверды, темно-серый, нерастворимый в воде, на воздухе окисляется основный Оксид железа (III) Fe2O3 Тверды, темнокоричневый, нерастворимый в воде основный Железная окалина Смесь FeO и Fe2O3 Обладает магнитными свойствами «магнитный железняк» Гидроксиды железа Название Формула Свойства Характер Гидроксид железа (II) Fe(OH)2 Тверды, белый, нерастворимый в воде, на воздухе окисляется основный Гидроксид железа (III) Fe(OH)3 Тверды, темно коричневый, нерастворимый в воде основный Оксид железа 1. Проявляет основные свойства, взаимодействуя с кислотами: FeO+H2SO4 = FeSO4 + H2O 2. Оксид железа (III) проявляет слабые амфотерные свойства, взаимодействуя при нагревании с основными оксидами с образованием ферритов: МnO + Fe2O3 =Mn (FeO2)2 Способы получения оксида и гидроксида железа (II) Fe→FeCl2→Fe(OH)2→FeO Осуществите цепочку превращений Способы получения оксида и гидроксида железа (III) Fe→FeCl3→Fe(OH)3→Fe2O3 Осуществите цепочку превращений Качественные реакции на ионы Fe2+ Fe3+ FeSO4 + K3 [Fe(CN)6 ] KFe +2 [Fe +3(CN)6 ] + K2SO4 = красная кровяная соль турнбулева синь FeCI3 + K4 [Fe(CN)6 ] = KFe+3 [Fe +2(CN)6 ] +3KCI желтая кровяная соль FeCI3 + 3 KCNS = берлинская лазурь Fe(CNS )3 +3KCI кроваво-красный Домашнее задание § 14, упр. 2, 4, 5