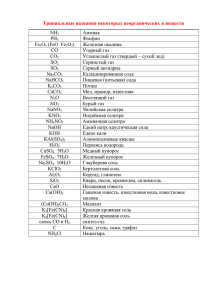
Химические свойства неорганических веществ
реклама

Химические свойства неорганических веществ Основных оксидов: с кислотами = растворимая соль + Н 2О с Н2О = основание (оксиды щелочных, щелочноземельных Ме, Mg) с кислотным оксидом = соль с амфотерным оксидом = соль с Н2,С,СО, Al, Mg = Ме + … ( пирометаллургия) Кислотных оксидов: со щелочами = соль + Н2О со щелочами = кислая соль с Н2О = кислота ( оксиды неМе кроме SiO2 ) с основными оксидами = соль с амфотерными оксидами = соль с солями летучих кислот = соль + кислотный оксид (газ) Амфотерных оксидов: с кислотами = растворимая соль + Н 2О с основными, кислотными оксидами или друг с другом = соль с расплавами щелочей = соль + Н2О с растворами щелочей = комплексная соль Al2O3+2NaOH+3H2O=2Na(Al(OH)4) Нерастворимых оснований: с кислотами = растворимая соль + Н2О (нейтрализация) разложение при t0 = оксид Ме + Н2О Щелочей: изменение окраски индикатора (диссоциация ОН-) с кислотами = растворимая соль + Н2О (нейтрализация) с солями (необратимая реакция) с кислотными оксидами = кислая соль или средняя соль + Н 2О с амфотерными оксидами = соль (t0) или комплексная соль (раствор) с Ме (Al, Zn) в растворе = комплексная соль + Н2 с неМе (Гал2) : 2F2 + 2NaOH (хол) = 2NaF + H2O + OF2 Cl2 + 2KOH (хол) = KCl + KClO + H2O 3Cl2 + 6KOH (гор) = 5KCl + KClO3 + H2O Cl2 + Ca(OH)2 = CaOCl2 + H2O возможен электролиз расплавов Щелочей: с органическими веществами: с галогеналканами (водн. р-р) = спирт + МеГ с галогеналканами (спирт. р-р) = алкен или алкин + МеГ + Н2О с фенолами (но не со спиртами) = фенолят Ме + Н2О со сложными эфирами (жирами)= CnH2n+1COOMe + спирт (глицерин) - щелочной гидролиз с кислотами и аминокислотами = соль + Н2О Амфотерных оснований: с кислотами = растворимая соль + Н2О (нейтрализация) разложение при t0 = оксид Ме + Н2О со щелочами (расплав) = соль + Н2О со щелочами (раствор) = комплексная соль Кислот: диссоциация на ионы, изменение цвета индикатора; с Ме до Н = растворимая соль + Н2 (кроме HNO3, H2SO4(конц.) с основаниями (нейтрализация) = кислая, средняя или основная соль + Н2О с основными и амфотерными оксидами = растворимая соль + Н2О с солями = реакция обмена (газ, осадок или Н2О) со спиртами = сложные эфиры + Н2О с неМе = ОВР H2S + I2= 2HI + S HNO3 + C, S, (P+ Н2О) H2SO4(конц.) + C,S HCl + окислители = ОВР HCl + MnO2 = MnCl2 + Cl2 + Н2О HNO3, H2SO4(конц.) + Mе = соль + Н2О + соединение S или N HNO3 + алканы = нитроалкан + Н2О (реакция замещения Коновалова) с аминами и аминокислотами = соединение по донорноакцепторному механизму возможен электролиз Солей: с Ме (кроме активных, электрохимический ряд Ме) = соль + Ме со щелочами = соль + основание (осадок, газ) с кислотами = средняя или кислая соль + кислота (газ, осадок, Н2О возможен гидролиз (изменение цвета индикатора) возможен электролиз (изменение цвета индикатора) совместный гидролиз в растворе с солями (осадок) с неМе: 2KI + Cl2 = 2KCl + I2 2FeCl2 + Cl2 = 2FeCl3 разложение нитратов : (акт. Ме, до Си, левее Си) NH4NO2 = N2 + 2Н2О NH4NO3 = N2O + 2Н2О с нелетучими оксидами соли летучих кислот Металлов: с растворами кислот (Ме до Н)= растворимая соль + Н2 (кроме HNO3, H2SO4(конц.) Mе + HNO3, H2SO4(конц.) = соль + Н2О + соединение S или N с Н2О = основание + Н2 (Ме до Al) с Н2О = оксид Ме + Н2 (Ме после Al до Н) с неМе = соль или оксид (пероксид) Ме (кроме активных, электрохимический ряд Ме) с солями = соль + Ме Al, Mg, Ca + оксиды Ме (в металлургии) Al, Zn с растворами щелочей = комплексная соль + Н2 Ме средней активности с угарным газом (СО) со спиртами и фенолами = соль + Н2 с галогеналканами = циклоалкан (Zn) или алкан с длинной цепью (Na)реакция Вюрца с карбоновыми кислотами и аминокислотами (Ме до Н) = соль + Н2 Na с первичными алкинами (реакция замещения) Неметаллов: Окислительные свойства: с Ме = соль, оксид, пероксид или солеподобное вещество с неМе с меньшей ОЭО со сложными веществами Восстановительные свойства: со фтором с неМе с большей ОЭО со сложными веществами Диспропорционирование