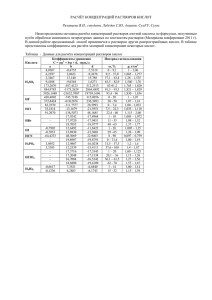
Расчет рН растворов и
реклама

Л Е К Ц ИЯ 1 Аналитическая химия. Химический анализ. доц. Л.В. Вронска Аналитическая химия. Химический анализ. 1. Предмет и задачи аналитической химии. Химический анализ и его виды. Значение аналитической химии для фармации. Методы анализа, их классификация. 2. Основные положения теории сильных электролитов. 3. Закон действующих масс в аналитической химии. Основные типы химических равновесий, которые используются в аналитической химии. 4. Протолитическая теория кислот и оснований. 5. pH растворов Основные разделы аналитической химии: Качественный анализ: дробный систематический методы Количественный анализ: 1. химические методы 2. инструментальные методы: - физические методы анализа - физико-химические методы анализа и В аналитической химии проводят: Элементный анализ Функциональный анализ Молекулярный анализ Фазовый анализ Структурный анализ Динамический анализ Фармацевтический анализ – определение качества лекарств и лекарственных средств аптечного и промышленного производства Фармацевтический анализ включает: анализ лекарственных препаратов анализ лекарственного сырья контроль производства лекарств токсикологический анализ судебно-химический анализ По количеству исследуемой пробы методы делят на: макроанализ (1–10 г вещества или 20– 100 мл раствора) полумикроанализ (0,05–0,5 г вещества или 1,0 – 10,0 мл раствора) микроанализ (10-3–10-6 г вещества или 101 –10-4 мл раствора) ультрамикроанализ (10-6 – 10-9 г вещества или 10-4–10-6 мл раствора) субмикроанализ (10-9–10-12 г вещества или 10-7–10-10 мл раствора) Сигнал, который несет информацию о элементарных объектах – аналитический сигнал. Чувствительность реакци: Минимальная (предельная) концентрация (Сmin) Предельное разбавление (W) Открываемый минимум (предел обнаружения) (m) 2.Основные положения теории сильных электролитов Г. Льюис в 1901 г. ввел понятие активности иона: Активность иона (а) – эффективная, воображаемая концентрация иона, соответственно которой он вступает в химические реакции a lim 1. C 0 C Для расчета коэффициентов активности рассчитывают: 1. Ионную силу раствора 1 2 C i Z i 2 2. коэффициенты активности в зависимости от значения ионной силы раствора по формулам Дебая-Хюккеля Формулы Дебая-Хюккеля для рассчета коэффициентов активности ионов если 0,01 lg f i 0,512Z i2 , если 0,1 2 0,512Z i lg f i , если 1,0 1 2 0,512Z i lg f i 0,1 Z i2 , 1 Экспериментально можно найти только усредненные коэффициенты активности: для бинарного электролита АВ f f A fB , для электролита состава AmBn f mn f Am f Bn , Среднее значение коэффициентов активности можно рассчитать теоретически по уравнениям Дебая-Хюккеля: если 0,01 lg f 0,512Z A Z B , если 0,1 0,512Z A Z B lg f , 1 если 1,0. 0,512Z A Z B lg f 0,1Z A Z B . 1 Для облегчения расчетов пользуются приближениями: 1. Коэффициенты активности ионов одинакового заряда независимо от радиуса ионов приблизительно равны. 2. Коэффициенты активности нейтральных частиц в разбавленных растворах электролитов равны 1. 3. Очень разбавленные растворы электролитов можно считать идеальными растворами. 3. Закон действующих масс в аналитической химии Концентрационная (реальная) константа химического равновесия KC nA + mB lC +pD [C ]l [ D] p [ A]n [ B]m показатель константы равновесия pK = –lgK. . КТ – термодинамическая константа равновесия p p l l aC a D fC f D T C K K ; n m n m a A aB f A fB КУ – условная константа равновесия p l CC C B У K , n m C A CB T У K K c d c C D fC b fa aA B A d fD . f Bb Основные типы химических реакций, которые применяются в аналитической химии: Протолитические Осаждения Комплексобразования Окислительно-восстановительные 4. Протолитическая теория кислот и оснований Классическая теория кислот и оснований Сванте Аррениуса кислота – соединение, которое вследствие диссоциации образует ионы Н+ основание – соединение, вследствие диссоциации гидроксид-ионы ОН–. которое образует В 1923 г. Бренстед и Лоури предложили протолитическую теорию кислот и оснований Кислоты – вещества, выделять протоны способные Основания – вещества, присоединять протоны способные Кислота Основание + Н+ А В + Н+ Константа равновесия реакции автопротолиза растворителя a a H Solv Solv 2 K T HSolv . 2 a HSolv Константа автопротолиза (ионное произведение) растворителя равна произведению активностей ионов лиония и лиата KT a HSolv a H 2 Solv Solv , Нейтральность среды определяется равенством активностей ионов лиония и лиата: a H 2 Solv a Solv , pH pSolv условие нейтральности pH 1 / 2 pK T HSolv Характеристики рН некоторых растворителей Растворител ь Границы рН Растворител ь H2SO4 0 – 3,6 C2H5OH HCOOH 0 – 6,70 CH3– C N 0 – 19,00 H2O 0-14 Границы рН 0 – 19,00 0 – 22,0 CH3COOH 0 – 14,4 NH3 (жидкий) CH3OH 0 – 17,3 ФМА 0 – 17,0 ацетон 0 – 21,1 ДМФА 0 – 18,0 Преимущества протолитической теории по сравнению с классической: общее описание кислотно-основных взаимодействий возможность количественной оценки силы кислот и оснований НА + Н2О Н3О+ + А– + + OH– B + H O BH a 2 a H O A 3 K aT a a T a HA BH OH Kb aB Растворители: протогенные протофильные амфипротные апротонные протоноакцепторные свойства возрастают H2SO4; CCl3COOH; CH3COOH; H2O; C2H5OH; NH3; C5H5N протонодонорные свойства возрастают Расчет рН водных растворов кислот и оснований. Расчет рН растворов сильных кислот и оснований pH lg C HA pOH lg C B Для разбавленных 2 4K C C HA W HA растворов сильных [ H ] 2 кислот и оснований: 2 C C 4 KW B B [OH ] . 2 Расчет рН растворов слабых кислот и оснований 2 4K K K HA HAC HA HA [H ] 2 2 K K 4 K BC B B B [OH ] . 2 Если слабая кислота (основание) мало диссоциирует ( 0,03 – 0,05), то рН: [H ] K HA C HA 1 1 pH pK HA lg C HA 2 2 [OH ] K B C B 1 1 pH 14 pK B lg C B 2 2 В разбавленных растворах (С 1 10–4 М) кислот (оснований) с К 10–6 [ H ] K HA C HA KW [OH ] K BC B KW Расчет рН смеси двух кислот (оснований) средней силы [ H ] K HA1 [ HA1 ] K HA2 [ HA2 ] [H ] KW K B1 [ B1 ] K B2 [ B2 ] Если степень диссоциации кислот (оснований) не превышает 5%, то рН можно рассчитать по общей концентрации кислоты (основания) [ H ] K C K C HA1 [H ] HA1 HA2 KW K B1 C B1 K B2 C B2 HA2 Расчет рН растворов амфолитов [H ] K H2 A( K HA ] K ) [ HA W K H2 A [H ] [ HA ] K H2 AK HA Расчет рН растворов солей Соль слабой основания кислоты и сильного [ OH ] K C B [ OH ] соли K C K W HA соли Расчет рН растворов солей Соль сильной основания кислоты и слабого [ H ] K C a [H ] K C K соли W B соли Расчет рН растворов солей Соль слабой основания кислоты [H ] и KW K HA KB слабого Расчет рН буферных растворов Механизм буферного действия Буфер: слабая кислота и ее соль (CH3COOH + CH3COONa) При добавлении ионов H+: CH3COO- + H+ CH3COOH При добавлении ионов OH-: CH3COOH + OH- CH3COO- + H2O Механизм буферного действия Буфер – слабое основание и его соль (NH3+NH4Cl) При добавлении ионов H+: NH3 + H+ NH4+ При добавлении ионов OH–: NH4+ + OH– NH3H2O Расчет рН буферных растворов С pH 14 pK lg С С pH pK lg С основания b кисл . a соли Буферная емкость C AC B П 2,3 C A CB соли Характеристика буферных растворов Буферная смесь рН Область рН эффективного использования HCOOH + HCOONa 3,8 2,8 – 4,8 C6H5COOH + C6H5COONa CH3COOH + CH3COONa 4,2 3,2 – 5,2 4,8 3,8 – 5,8 NaH2PO4 + Na2HPO4 6,6 5,6 – 7,6 NH4OH + NH3 9,2 8,2 – 10,2 Протолитические равновесия в неводных растворах По полярности Полярные растворители: 30 (владеют диссоциирующим действием) Малополярные растворители: =10 30 (слабое диссоциирующее действие) Неполярные растворители: 10 (не имеют диссоциирующего действия) За кислотно-основными свойствами растворители: протогенные протонные: протофильные амфипротные апротонные За способностью ионизировать ковалентные связи растворители ионизирующие неионизирующие Для расчета рН растворов в неводных растворителях необходимо: значение константы автопротолиза соответствующего растворителя значение константы кислотности (основности) кислоты (основания) в этом растворителе Спасибо за внимание!