Соединения серы.
реклама

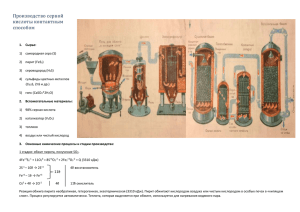
сера Тест 1) Укажите число валентных электронов и число неспаренных электронов в основном состоянии атома серы: а) 6 и 0 в) 6 и 2 б) 3 и 4 г) 7 и 1 2) Укажите число протонов в ядре атома серы: а) 8 в) 2 б) 15 г) 16 3) Укажите аллотропную модификацию серы, которая наиболее устойчива при комнатной температуре: а) ромбическая б) жидкая в) моноклинная г) пластическая 4) Укажите формулу высшего оксида серы: а) SO в) SO3 б) SO2 г) H2SO4 5) Соединения простых веществ с серой называют: а) гидросульфаты б) сульфаты в) сульфиты г) сульфиды 6) При горении серы на воздухе образуется: а) H2S в) SO3 б) SO2 г) H2SO4 7) Выберите из предложенных вариантов формулу цинковой обманки: а) HgS в) SO3 б) ZnS г) H2SO4 Соединения серы. Урок подготовила Дуланова И.Т. S0 -2 S +4 S И окислитель и восстановитель Только окислитель S Только восстановитель +6 H2S -2 Сероводород в Чёрном море Пользуясь учебником (параграф 23 пункт первый) объясните схему, изображенную на слайде №7. Ответьте письменно на следующие вопросы: 1) Назовите природные источники сероводорода. Сероводород содержится в вулканических газах. 2) Назовите места, в которых образуется сероводород. Сероводород образуется на дне Черного моря. 3) Назовите процессы, в результате которых образуется сероводород. В результате процесса разложения (гниения) белковых тел образуется сероводород. 4) Запишите схему химического процесса, который происходит с сероводородом при подъеме с морского дна при недостатке кислорода. 2Н2S-2 + O20 = 2S0↓ + 2Н2O-2 5) Запишите схему реакции взаимодействия сероводорода с избытком кислорода. 2Н2S-2 + 3O20= 2S+4О2+ 2Н2O-2 SO2 +4 «Последний день Помпеи» К. П. Брюллов Сернистый газ выделяется из трещин пород с кристаллической серой. • Ответьте на вопрос со слайда. •Пользуясь учебником и конспектом напишите известные вам способы получения сернистого газа. S + O2 = SO2 t • Назовите вещество, в которое превращается сернистый газ при растворении его в воде. Сернистая кислота •Напишите уравнение этой реакции. H2O + SO2 = H2SO3 При извержении Везувия в Римской империи погибло много людей и не только от разрушений при землетрясении. Назовите ещё одну причину, которая вызвала гибель людей. Сернистая кислота очень неустойчива и разлагается на исходные вещества: H2SO3 H2O + SO2 Сернистая кислота двухосновная и образует два вида солей.Назовите и запишите их формулы. NaHSO3 Гидросульфит натрия Na2SO3 Сульфит натрия SO3 +6 При окислении оксида серы (IV) образуется оксид серы (VI). Напишите уравнение реакции. t, V2O5 2SO2 + O2 2SO3 При растворении оксида серы (VI) в воде получается серная кислота. Напишите уравнение реакции. +6 +6 S O3 + Н2О =Н2 S O4 Назовите вещества, которые входят в состав олеума. Раствор оксида серы (VI)SO3 в серной кислоте. Взаимодействие серной кислоты с металлами Одинаково ли взаимодействует с металлами концентрированная и разбавленная серная кислота? После просмотра опыта ответьте на поставленный вопрос и заполните таблицу: Реактивы Что наблюдал УХР/в молекулярном виде и электронный баланс. Выводы. Взаимодействие серной кислоты с металлами Реактивы Что наблюдал Zn и H2SO4 (разб) Выделение пузырьков газа Cu и H2SO4(разб) Реакция не идет Zn + H2SO4(разб) = ZnSO4 + H2 Zn0 -2e = Zn+2 2H+ +1e = H02 Cu + H2SO4(разб) == Zn и H2SO4 (конц) Выделение пузырьков газа 4Zn + 5H2SO4(конц) = 4ZnSO4 + H2S + 4H2O Cu и H2SO4(конц) Выделение пузырьков газа УХР/в молекулярном виде и электронный баланс. Выводы. Zn0 -2e = Zn+2 4 S+6 +8e = S-2 1 Cu + 2H2SO4(конц) = CuSO4 + SO2 + 2H2O Cu0 -2e = Cu+2 S+6 +2e = S+4 Дайте определение понятию гигроскопичность. Гигроскопичность - свойство вещества поглощать влагу из воздуха и из молекул органических веществ. Качественная реакция на сульфит и сульфат - ионы. После просмотра видео опыта заполните таблицу: Реактивы BaCL2, Na2SO3, Na2SO4 Что наблюдал УХР/в молекулярном и ионном виде Выводы. ВаСl2+Na2SO3 = 2NaCl + BaSO3 ВаСl2+Na2SO4 = 2NaCl + BaSO4 Выпадение белого осадка 2+ Ba + SO 24 = BaSO4 2+ Ba + SO 23 = BaSO3 Выводы: 0 S -2 +4 +6 S S S H2S SO2 SO3 Н2SO3 Н2SO4 NaHS, Na2S NaНSО3 , Na2SО3 NaНSО4 , Na2SО4 Домашнее задание. • § 23, упр. 1-8, подготовить сообщение/ презентацию на выбор по темам: «Применение серной кислоты в промышленности», «Применение серной кислоты в медицине, «Соединения серы в природе», «Осторожно! Соединения серы!». • По темам сера и соединение серы(§22,§23), составить кроссворд из пяти и более вопросов.