1) Для белков с молекулярной массой, больше чем 10 кДа
реклама

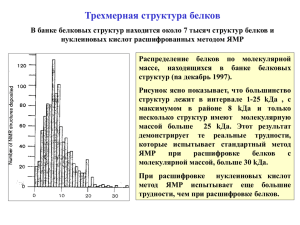
Трехмерная структура белков В банке белковых структур находится около 5 тысяч структур белков и нуклеиновых кислот расшифрованных методом ЯМР. Распределение белков по молекулярной массе , находящихся в банке белковых структур (nа декабрь 1997). Рисунок ясно показывает, что большинство структур лежит в интервале 1-25 kDa , с максимумом в районе 8 kDa и только несколько структур имеют молекулярную массой больше 25 kDa. Этот результат демонстрирует те реальные трудности, которые испытывает стандартный метод ЯМР при расшифровке белков с молекулярной массой, больше 30 kDa. При расшифровке нуклеиновых кислот метод ЯМР испытывает еще большие трудности, чем при расшифровке белков. Белки небольшого размера (до 10 кДа) Трехмерная структура протеазного ингибитора из семени быка) “The completion of the first protein NMR structure brought new, unexpected challenges. When I presented the structure of BUSI (Fig. la) in some lectures in the spring of 1984, the reaction was one of disbelief, and because of the dose coincidence (Fig. Ib) with results from an independent crystallographic study of the homologous protein PSTI (porcine pancreatic secretory trypsin inhibitor). It was suggested that our structure must have been modeled after this crystal structure. In a discussion following a seminar in Munich on May 14, 1984, Robert Huber (Nobel Prize in Chemistry, 1988) proposed that we settle the matter by independently solving a new protein structure by X-ray crystallography and by NMR. For this purpose, each one of us received an ample supply of the α-amylase inhibitor tendamistat from scientists at the Hoechst company. Virtually identical three-dimensional structures of tendamistat were obtained in our laboratory by NMR in solution and in Robert Huber's laboratory by X-ray diffraction in single crystals. The refined tendamistat structure was published in Journal of Molecular Biology as a 50-page report, and the addendum to that paper dearly illustrated the impact of structure determination by NMR.” Wuthrich K., (2001) The way to NMR structure, Nat. Struct. Biol. 8, 923-925 Стратегия структурных исследований из ЯМР данных (не по правилам, а по понятиям!!!) 1. Информация о коротких расстояниях (<5Å) Nuclear Overhauser Enhanced Spectroscopy Основной источник геометрической информации в спектрах ЯМР получается из эффекта Оверхаузера (NОЕ). Так как этот эффект обратно пропорционален шестой степени расстояния между протонами, то его интенсивность очень быстро затухает при увеличении расстоянии между ними. Однако несмотря на это эффект Оверхаузера поставляет львиную долю информации при определении трехмерной структуры биологических макромолекул. Он оказывается особенно информативен, когда указывает на близость протонов далеко удаленных по цепи. 2. Информация о длинных расстояниях (>5Å) , Преимущественная ориентация макромолекул в фосфолипидных бицеллах ( phospholipid bicelles), палочкообразных фагах Pf1 и т.д. Bo Pf1 phage Белки среднего и большого размера (2O-60 kDa) 1) Для белков с молекулярной массой, больше чем 10 кДа стандартные подходы, основанные на анализе 1H 2D спектров не годятся из-за сильной перекрываемости таких спектров. 2) Для белков с молекулярной массой в интервале 15-20 kDa применяется многоядерный (тройной)резонанс, основанный на корреляции между ядрами 1H, 13C и 15N 2) 3) Для белков, с молекулярной массой больше чем 20 кDа для упрощения спектров необходимо дейтерирование молекулы, степень которого зависит от молекулярной массы. Так, полного определения 3D структуры белка с молекулярной массой 30 кDа необходимо 90% дейтерирование. 1) 4) Для белков, с молекулярной массой больше чем 30 кDа разработаны изощренные схемы селективного мечения по 13Cα and 13Cβ атомам. Необходимая высокая степень дейтерирования (95%) сочетается с адресным мечением водородов. Используются специальные очень сложные импульсные схемы (TROSY). ЦЕНА ЭКСПЕРИМЕНТА!! Европейские центры ЯМР. Стратегия мечения белков Goto and Kay (2000), Current Opinion in Structural Biology, 10, 585-592. 13C Дейтерирование и 15N мечение 1) Выращивание Е. Coli на синтетических средах, содержащих соли меченые 13C и 15N. 1) однородное (полное или частичное) 2) Использование для этой цели Pichia pastoris (клетки китайского хомячка). 3) селективное (мечение метильных групп аланина, валина, лейцина, изолейцина или ароматических аминокислотных остатков 3) Использование бесклеточных систем экспрессии. 2) селективное (добавление 2H аминокислот) 4) Сегментальное мечение (сшивание 1H и 2H полипептидных цепей с помощью белка интеина) Стратегия мечения РНК Tolbert and Williamson (1996) J. Am. Chem. Soc, 118, 7929-7940 Дейтерирование 1. Использование Т7 РНК полимеразы для сшивания коротких РНК цепей 13C и 15N мечение (так же как у белков) 2. Разработка эффективных методов химического и энзиматического синтеза дейтерированных трифосфатов 3. Селективное мечение H5' протонов в тимидине и H3' в аденозине. 4. Химический синтез нуклеозидов из изотопически меченой рибозы и оснований Стратегия мечения ДНК (слабо разработанаа0 Gardner and Kay (1998) Annu. Rev. Biophys. Biomol. Struct,. 27, 357-406 Большие и очень большие макромолекулярные комплексы. В настоящее время считается, что макромолекулярные структуры с молекулярной массой больше 60 кDа недоступны методу ЯМР. Однако, с помощью различных ухищрений можно исследовать такие структуры. На рисунке (вверху) показана структура белка GroES (72 kDa). Этот белок является олигомерным белком, состоящим из 7 субьединиц, одна из которых оттенена золотым цветом. На этом же рисунке внизу показана модель комплекса GroES и GroEL (472 kDa). Голубым цветом окрашена часть GroEL, которая не мечена изотопически и не видна в ЯМР эксперименте. Это дает возможность сравнить структуру GroES в изолированном состоянии ив составе комплекса. ЯМР в эпоху структурной геномики Влияние доли неструктурированных областей на выбор метода определения структуры. Обозначение NMR-ONLY означает, что только метод ЯМР использовался для определения структуры, тогда как обозначение NMR_XRAY означает, что и ЯМР и рентгеновская дифракция были использованы. ЯМР структура рекомбинантного белка приона крысы. В исходном белке, структурирован только один сегмент с 126 по 226 остаток, тогда как остальная часть молекулы с 23 по 126 остаток не структурирована вовсе. Амидная область одномерного спектра голубого флюоресцентного белка (BFP) в присутствии (B) и отсутствии Ca2+ (D). Вид спектров позволяет предположить, что в присутствии Ca2+ есть надежда вырастить хорошие кристаллы, тогда как без Ca2+ таких надежд практически нет. Обратите внимание, что получение одного одномерного спектра требует всего 15 min ЯМР нуклеиновых кислот Статистика за последние 5 лет, показывает существенный рост числа структур нуклеиновых кислот, расшифрованных методом ЯМР. Так если в 1997 году, были расшифрованы 137 структур нуклеиновых кислот и 784 белковых структур, то в 2001, году уже было 419 структур нуклеиновых кислот и 1775 белковых структур. Такое соотношение (1:4) наблюдается и сегодня. Рисунок демонстрирует основную трудность с которым сталкивается метод ЯМР при расшифровке нуклеиновых кислот. Так, если для белков NOE контакты удается получить между протонами, находящимися далеко по цепи (а), то для нуклеиновых кислот (б) такие контакты ограничены протонами, находящимися близко по цепи. Это сильно ограничивает верхний предел массы нуклеиновых кислот, доступных методу ЯМР Глобальные изменения в структуре т-РНК, наблюдаемые методом ЯМР. В интерпретации этих данных частично использованы данные по рентгеновской дифракции. Рентгеновская ЯМР в медицине. Трех мерное изображение ЯМР-томография ультразвуковая Иллюстрация поглощения человеческими тканями различных типов излучения. Три типа диагностики тканей оказываются возможными: рентгеновская (длина волны 110Å), ультразвуковая (длина волны около 0.1-1 см) и ЯМР-ная (длина волны > 1 м). Такая длина волны позволяет получить изображение разве что слона. Выход состоит в использовании градиента в магнитном поле. Если магнитное поле имеет градиент 1 x 10-5 тесла/cм, то протоны, отстоящие друг от друга на 1 см будут иметь разницу в резонансной частоте в 425 Hz. Изменяя несущую частоту ЯМР с таким шагом можно просканировать объект с шагом 1 см вдоль магнитного градиента. Для получения трехмерного изображения объекта необходимо иметь три градиента магнитного поля во взаимно перпендикулярных направлениях. Такой прибор называется томографом. Magnetic resonance image of Homo sapience. The image took approximate 5 min to record. Bar: 10 mm Light microscopy (a) and microscopic resonance imaging (side view, (b) and top view (c) of a living embryo