ppt Азот-25 слайдов Размер: 15325 кБ
реклама
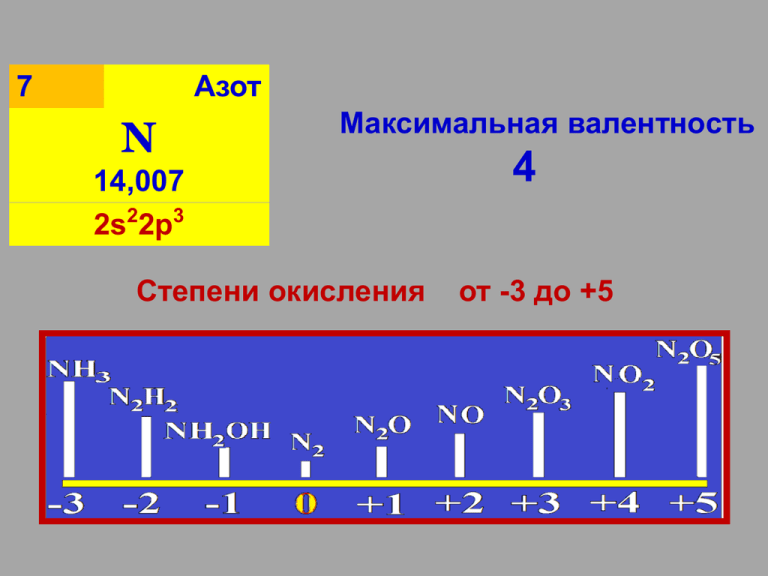
Азот 7 N Максимальная валентность 14,007 2s22p3 Степени окисления 4 от -3 до +5 Азот N2 устойчивость: N2 ↔ 2N ∆H0298 = 945,3 кДж/моль Получение в промышленности: фракционная перегонка жидкого воздуха. Получение в лаборатории: NаNO2+ NH4Cl NH4NO2 + NаCl NH4NO2 N2 + 2H2O -3 Нитриды: основные (Na3N, Mg3N2), амфотерные (AlN), кислотные (Si3N4). Необратимый гидролиз: Li3N + 3H2O 3LiOH + NH3 BN + 3H2O B(OH)3+ NH3 Аммиак -3 Температура кипения -33,34°C Температура плавления -77,73°C Получение. в лаборатории : 2NH4Cl + Ca(OH)2 CaCl2 + 2H2O + 2NH3 в промышленности : (t=4500С, Р=300 атм.) : t0 N2(г) + 3H2(г) 2NH3(г) t0 -3 Молекула аммиака – донор электронной пары (основание Бренстеда): NH3 + H+ [NH4]+ NH3 + H2O ↔ NH3·H2O NH3·H2O ↔ NH4OH NH4OH↔ NH4+ + OH- (гидроксид аммония - слабое основание по теории Аррениуса) Идентификация аммиака: ? -3 NH3 - восстановитель: 4NH3 + 3O2 4NH3 + 5O2 Горение: 2N2 + 6H2O 4NO + 6H2O катал изатор 3CuO + 2NH3 N2 + 3Cu + 3H2O 8NH3 + 3Br2 N2 + 6NH4Br 3NH3 + 4KClO3 + 3NaOH 3NaNO3 + 4KCl + 6H2O -3 Cо щелочными и щелочноземельными Ме образует амиды : 2Na + 2NH3 2NaNH2 + H2 Внимание! Здесь аммиак – окислитель. -3 Соли аммония (NH4Cl, NH4NO3, …..) Гидролиз по катиону: NH4+ + H2O ↔ NH4ОH + H+ потому что гидроксид аммония - слабое основание NH4OH↔ NH4+ + OH- -3 Соли аммония Образуются: NH3 + HCl NH4Cl Термическое разложение (сравните): анион – неокислитель: NH4Cl ↔ NH3 + HCI (NH4)2CO3 ↔ 2NH3 + CO2 + H2O анион – окислитель: NH4NO3 N2O + 2H2O NH4NO2 N2 + 2H2O (NH4)2Cr2O7 N2 + Cr2O3 + 4H2O -3 Соли аммония NH4Cl (нашатырь) –восстановитель: (удаление оксидных пленок) 4CuO + 2NH4Cl 3Cu + CuCl2 + N2 + 4H2O Fe3O4 + 8NH4Cl FeCl2 + 2FeCl3 + 8NH3 + 4H2O -2 N2H4 - ГИДРАЗИН бесцв. вязкая жидкость, очень ядовит, гигроскопичен,склонен к самовоспламенению. Сильный восстановитель: 2Cu(OH)2 + N2H4 2Cu + N2 + 4H2O N2H4 + 2H2O2 N2 + 4H2O N2H4 + 2I2 N2 + 4HI 4KMnO4+5N2H4+6H2SO45N2+4MnSO4+2K2SO4+16H2O используется как компонент ракетного топлива, т.к. при реакции: N2H4 + O2 N2 + 2H2O выделяется > Q и газообразных продуктов. -1 NH2OH -гидроксиламин белое гигроскопичное, кристаллическое вещество ОВ-двойственность: 2NH2OH + I2 + 2KOH N2 + 2KI + 4H2O 2NH2OH+4FeSO4+3H2SO42Fe2(SO4)3+(NH4)2SO4+2H2O +1 N2 O Несолеобразующий: с H2O, кислотами, щелочами - не реагирует. окислитель: N2O + H2 N2+ H2O N2O + SO2 + H2O N2 + H2SO4 +2 NO – радикал→ димеризуется (N O ) 2 2 бесцв. газ, в тв. и жд. состоянии синего цвета, плохо раств. в H2O. Получение: 4NH3 + 5O2 4NO + 6H2O 3Cu + 8HNO3 3Cu(NO3)2 + 2NO+ 4H2O NO– eNO+нитрозил-ион NO+eNO-нитрозид-ион +2 NO ОВ-двойственность: 2H2S + 2NO N2 + 2S + 2H2O 2SO2 + 2NO 2SO3 + N2 2NO+K2Cr2O7+4H2SO42HNO3+K2SO4+Cr2(SO4)3+3H2O 2NO + O2 2NO2 +3 N2O3, HNO2 , нитриты N2O3 - бурый яд. газ, NO2 + NO = N2O3 при t ниже –400С синяя жидкость, при t =-1010С-тв. В жид. и газ. состоянии диссоциирует: N2O3 = NO2 + NO С водой и щелочами (кислотный оксид): N2O3 + H2O 2HNO2 N2O3 + Ca(OH)2 Ca(NO2)2 +H2O Неустойчива: 2HNO2 ↔NO2 + NO + H2O существует только в очень разбавленных растворах ниже 00С. Слабая кислота: HNO2 ↔H+ + NO2К(HNO2)= 4.10-4 Получение при охлаждении до 00С: NO2 + NO + H2O 2HNO2 Ba(NO2)2 + H2SO4 2HNO2 + BaSO4 +4 Получение в лаборатории: Cu+4HNO3(конц.)Cu(NO3)2+2NO2+2H2O Диспропорционирование: 2NO2+H2OHNO2+HNO3 2NO2 + 2KOH KNO2 + KNO3 + H2O Окислитель (сильнее чем HNO2 и HNO3): 2NO2 + 2HI 2HNO2 + I2 2NO2 + SO2 + 2H2O 2HNO2 + H2SO4 В атмосфере NO2 горят углерод, фосфор и сера: 2NO2 + 2C N2 + 2CO2 +4 +5 N2O5 (азотный ангидрид) бесцв. кристаллы с tпл 300оС. Кристаллы имеют ионную структуру NO2+ . NO3- (нитрат нитроила). Получение: 6HNO3 + P2O5 3N2O5 + 2H3PO4 С водой: N2O5 + H2O 2HNO3 Сильный окислитель: 2N2O5 + 2H2S 2N2 + 2H2SO4 + O2 N2O5 + SO2 N2 + SO3 + 2O2 +5 HNO3 бесцв. жидкость, "дымящая" на воздухе. Сильная кислота, диссоциирует: HNO3 H+ + NO3На свету разлагается: 4HNO3 4NO2 + 2H2O + O2 сильный окислитель Восстанавление азота до: NO2, N2O3, NO, N2O, N2, NH3 (NH4NO3). Чем разбавленнее HNO3, тем глубже восстанавливается азот. +5 HNO3 HNO3 (конц.)+ Ме (до алюминия в ряду напряжений) → N2O: 4Ca + HNO3конц. 4Ca(NO3)2 + N2O + 5H2O 4Zn + 10HNO3очень раз. 4Zn(NO3)2 + NH4NO3 + 3H2O неМе (и малоактивные Ме) + HNO3(конц. ) →NO2: B + 3HNO3конц. H3BO3 + 3NO2 S + 6HNO3конц. H2SO4 + 6NO2 + 2H2O неМе (и малоактивные Ме) + HNO3(разб. ) → NO: 3P + 5HNO3разб. + 2H2O 3H3PO4 + 5NO Смесь конц. HCl и конц. HNO3 3:1 - "царская водка“, т.к. растворяет Au и Pt : HNO3 + 3HCl Cl2 + 2H2O + NOCl NOCl разлагается: 2NOCl 2NO + Cl2 Окислительные свойства обеспечивает хлор. Окисление царских Ме: Au + HNO3 + 3HCl AuCl3 + NO + 2H2O 3Pt + 4HNO3 + 12HCl 3PtCl4 + 4NO + 8H2O https://www.youtube.com/watch?v=2E4_rITQb8w Характеристика элементов электронная конфигурация атомов ______ радиус э/о степени окисления N от -3 до +5 P -3,+1, +3,+4,+5 As -3,+3,+5 Sb -3,+3,+5 Bi +3,+5 Характеристика простых веществ Аллотропия:_________________________ Тип связи:_____________ Строение:____________________ Нахождение в природе Простые вещества:___________________ Соединения:__________________ Получение: В промышленности: ___________________________________ Получение азота лаборатории: ___________________________________ Свойства простых веществ Взаимодействие с металлами ________, кислородом ______________________, с водородом(только азот):___________ Соединения с водородом (молекулярного строения) тип связи________________________ NH3 PH3 основные свойства . Устойчивость по группе__________________ Получение аммиака в лаборатории: NH4Cl+Ca(OH)2=____________________ (сильное основание вытесняет слабое) Кислородные соединения азота. Оксиды азота:1) несолеобразующие________ 2) кислотные___________ Кислоты____________________ Соли:__________________ Качественная реакция на нитрат-ион :_______ Кислородные соединения фосфора. (по тому же плану) Получение фосфина : Ca3P2 + 6H2O =________________________ (гидролиз фосфидов) Задания: 1) Закончить составление блок-схемы. 2) Написать реакции, доказывающие: окислительно-восстановительную двойственность нитритов. 3)Написать уравнения реакций взаимодействия концентрированной и разбавленной азотной кислоты с Cu, Zn, Mg, Fe, Cr ,P, S. Указать условия их проведения. 4) Разложение нитратов при нагревании:________






