Т. Кременчугская Научные руководители: М.В.Головизнин Н.С.Лахонина
реклама

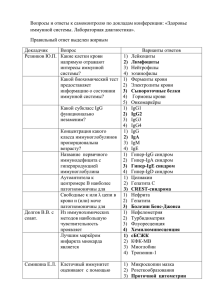
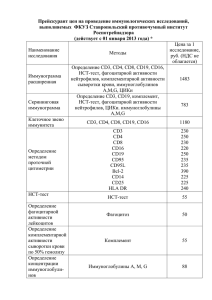
Московская на Юго-Западе Гимназия №1543 Т. Кременчугская Научные руководители: М.В.Головизнин Н.С.Лахонина Москва, 2011 г. Ревматоидный артрит – это хроническое системное воспалительное аутоиммунное заболевание, при котором главным образом поражаются суставы. Ревматоидный артрит – самое широко распространненое аутоиммунное заболевание, им страдает по разным оценкам от 0,5% до 2% всего населения планеты. Патогенез многих аутоиммунных заболеваний, в т.ч. ревматоидного артрита в настоящее время до конца не ясен, но многие исследователи сходятся на том, что важную роль в развитии заболевания играют Т-лимфоциты. CD3 – основной маркер Т-клеток, связанный с Тклеточным рецептором(TCR). CD4 – в основном, маркер Т-хелперных клеток. СD8 – маркер Т-киллерных и Т-супрессорных клеток. СD31 – маркер «недавних тимических мигрантов» (предшественников всех субпопуляций). HLA-DR – белок комплекса гистосовместимости II класса, присутствует на мембранах активированных клеток. О дисфункции тимуса может свидетельствовать «незрелый», аномальный рецепторный фенотип Т-клеток. Нарушение количественного соотношения между популяциями также может быть связано с развитием заболевания. Рис.1 Созревание Т-лимфоцитов.(Marilyn Thoman, SDSU BioScience Center) Метод лазерной проточной цитометрии использует моноклональные антитела, которые связываются с клеточным маркером и помечены флуоресцентным красителем. В цитофлуорометре клетки проходят через капилляр, пересекаемый лучом лазера. Датчики фиксируют рассеяние света, по характеру которого можно судить о количестве окрашенных клеток, т.е. клеток с искомым маркером. Рис. 2. Метод магнитной сепарции.(www.invirogen.com) Магнитная сепарация позволяет разделять субпопуляции клеток благодаря магнитным частицам (бусам), нагруженным антителами. Это повышает эффективность анализа, поскольку антитела добавляют к более узкой группе клеток. Нюансы этой методики в экспериментальной работе и клинических исследованиях изучены недостаточно. Цель работы – изучить рецепторный фенотип основных субпопуляций Тлимфоцитов периферической крови больных ревматоидном артрите в сравнении со здоровыми донорами и исследовать возможности сепарации CD3- и CD3+лимфоцитов с помощь. ферромагнитных бус с оценкой субпопуляционного состава до и после сепарации. Задачи: 1) Изучить имеющиеся в литературе данные о фенотипическом составе Тлимфоцитов при ревматоидном артрите. 2) Ознакомиться с методикой подготовки лимфоцитов к проточной цитометрии и основами самой этой методики. 3) Освоить методику выделения мононуклеарных клеток из крови, инкубацию их с моноклонакльными антителами перед целевой цитометрией. 4) Ознакомиться с методикой сепарации CD3- и CD3+-лимфоцитов с помощьюе ферромагнитных бус и освоить метод подготовки лимфоцитов к магнитной сепарации. 5) Исследовать выборку доноров и больных ревматоидным артритом на наличие маркеров CD3, CD4, CD8, CD31, HLA-DR. Работа была выполнена в лаборатории отдела клеточного иммунитета Государственного научного центра "Институт иммунологии" Федерального медико-биологического агентства России. В ходе работы методом лазерной проточной цитометрии были обследованы 11 доноров(63±13,6 лет) и 20 больных ревматоидным артритом(58±8,6 лет), являвшиеся пациентами ЦКБ ГА и Первой Городской клинической больницы. Методом магнитной сепарации с использованием ферромагнитных бус были обследованы 3 больных и 1 донор. Первым этапом эксперимента было выделение путем центрифугирования с раствором фиколлверографина суспензии мононуклеарных клеток. Затем опционально проводилась магнитная сепарация CD3- и CD3+-клеток(с использованием ферромагнитных бус Dynabeads). К образцам целевой суспензии добавлялись антитела для создания одинарной или двойной метки(пр-ва ООО «Сорбент»), например, CD3+ и CD4+. Окрашенные клетки исследовались на цитофлоурометре BD FACSCalibur, далее анализировались получаемые диаграммы рассеяния. Рис.1 Первичная диаграмма светорассеяния Рис.2 Гистограмма процентного содержания CD3+ иCD4+-клеток Уровень CD3+CD4+-клеток и у доноров, и у больных не различается значительно между собой. Рис.3 Процент CD3+CD4+-клеток от общего числа CD3+ клеток у доноров. Рис.4 Процент CD3+CD4+-клеток от общего числа CD3+ клеток у больных ревматоидным артритом. У больных наблюдается тенденция к снижению числа CD3+CD8+-клеток по сравнению с донорами, но это необходимо изучать далее(предварительный вывод). Рис.5 Процент CD3+CD8+-клеток от общего числа CD3+ клеток у доноров. Рис.6 Процент CD3+C8+-клеток от общего числа CD3+ клеток у больных ревматоидным артритом. Число атипичных CD3-CD4+-клеток и у доноров, и у больных крайне мало. Рис.7 Процент CD3-CD4+-клеток от общего числа клеток мононуклеарной суспензии у доноров. Рис.8 Процент CD3-CD4+-клеток от общего числа клеток мононуклеарной суспензии у больных ревматоидным артритом. Иммунорегуляторный индекс CD4+/CD8+ у больных ревматоидны артритом повышен(3,94±2,98%), что связано с гиперактивностью иммунной системы. По нашим данным, число активированных клеток(HLA-DR+) в крови больных оказалось мало – 6,78±3,92%. Это объясняется тем, что активированные к-ки находятся в синовиальной жидкости. Незрелых Т-хелперных клеток(CD31+CD4+) также обнаруживается очень мало – от 0% до 2,09%. Это очень важная популяция и исследования в этой области надо продолжать. Рис.9 Процент CDHLA-DR+-клеток от общего числа клеток мононуклеарной суспензии у больных. Рис.10 Процент CD31+CD4+-клеток от общего числа клеток мононуклеарной суспензии у больных. Наиболее интересными оказались данные, полученные в случае разделения клеток магнитной сепарацией. После процедуры в суспензии и у больных, и у донора обнаруживалось большое число(до 31,41%)CD3-CD4+клеток при том, что исходно их не было. CD3-CD4+,% 0,89 0,29 0,27 0,65 CD3-CD4+ п.м.с.,% 5,07 29,2 29,92 31,41 Пациент Больной 1 Больной 2 Больной 3 Донор Таблица№1. Процентное содержание CD3-CD4+-клеток до и после магнитной сепарации. Такое количество атипичных клеток после сепарации, скорее всего, связано не с нарушением созревания Т-лимфоцитов, а с т.н. "модуляцией" CD3 внутрь клетки после контакта с бусами. Т-хелперы, вероятнее, делают это в большей степени чем Т-супрессорных клеток. Возможно, такой эффект модуляции имеет место и в живом организме при контакте клеток с внеклеточными структурами. Рисунок№11. Появление псевдонезрелых клеток. На диаграмме А) до сепарации CD3-CD4+-клеток 0,27%, а после сепарации(диаграмма Б)) CD3-CD4+-клеток 29,92%. Освоены методики подготовки клеток к лазерной проточной цитометрии и магнитной сепарации. Выявлены некоторые тенденции в изменении фенотипа Т-лимфоцитов, которые в дальнейшем предстоит проверить. Обнаружен ранее не описанный феномен модуляции CD3 при контакте клеток с магнитными бусами. Данное исследование было выполнено в лаборатории отдела клеточной иммунологии Государственного научного центра «Институт иммунологии» Федерального медико-биологического агенства России, и я выражаю благодарность руководителю отдела, Александру Александровичу Ярилину за возможность проведения этой работы, сотрудников лаборатории за помощь в получении данных, моих научных руководителей – Марка Васильевича Головизнина и Наталью Сергеевну Лахонину за чуткое руководство, моего рецензента Евгения Яковлевича Парнеса за ценные конструктивные замечания и Сергея Менделевича Глаголева за организацию практики.