НАТРИЙ ЩЕЛОЧНОЙ МЕТАЛЛ
реклама

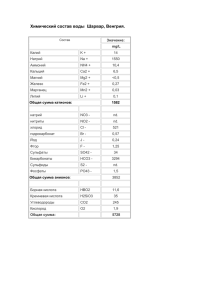
НАТРИЙ ЩЕЛОЧНОЙ МЕТАЛЛ История открытия Na Первое знакомство человека с металлами произошло несколько десятков тысяч лет назад. В 1807 г. Г.Дэви приступает к восстановлению натрия из едкого натра. Использовав более мощный вольтов столб, он выделяет натрий , который по свойствам напоминает калий. Калий и натрий получались за счёт присоединения электронов ионам данных металлов: + _ + _ К + е = К, Na + e = Na. Несмотря на кажущуюся простоту опыта Г.Дэви, получить этим методом натрий не так-то просто. Объясняется это тем, что твёрдые щёлочи имеют довольно высокое сопротивление. Поэтому вначале нужно применять большое напряжение, например 50 – 60 в. По мере прохождения электрического тока происходит разогревание щёлочи и её сопротивление падает. Поэтому напряжение нужно уменьшить. Нахождение в природе. В природе щелочные металлы в свободном виде не встречаются. Натрий входит в состав различных соединений. Наиболее важным является соединение натрия с хлором NaCl, которое образует залежи каменной соли ( Донбасс, Соликамск, Соль-Илецк и др.). Хлорид натрия содержится также в морской воде и соляных источниках. Натрий относится к числу распространённых элементов. Содержание натрия в земной коре составляет 2,64 %. Получение натрия. Натрий получают электролизом расплавленного хлорида натрия или гидроксида натрия. При электролизе расплава NaCl на катоде выделяется натрий: + _ Na + e =Na а на аноде – хлор: _ _ 2Cl - 2e =Cl2 При электролизе расплава NaOH на катоде выделяется натрий( уравнение реакции приведено выше), а на аноде – вода и кислород: _ _ 4OH - 4e =2H2O + O2 Вследствие дороговизны гидроксида натрия основным современным методом получения натрия является электролиз расплава NaCl. Физические свойства. Натрий очень мягкий металл с малой плотностью, малой электроотрицательностью, малым потенциалом ионизации, низким температурой кипения и плавления; чрезвычайно реакционноспособен, растворим в жидком аммиаке, аминах, эфирах. Оксиды и гидроксиды – сильные основания. Натрий – серебристо-белого цвета, легкий (легче воды), очень мягкий, легко режется ножом. Окрашивание пламени натрия – жёлтое( при качественном реакции ). Химические свойства. Взаимодействуют с простыми веществами: 1)с кислородом: 2Na + O2 = Na2O2 ( в обычных условиях ) 2)с галогенами: 2Na + Cl2 = 2NaCl ( галогенид ) 3)с серой при нагревании: 2Na + S = Na2S ( сульфид ) 4)с азотом: 6Na + N2 = 2Na3N ( нитрид ) 5)с водородом при нагревании: 2Na + H2 = 2NaH ( гидрид) 6)с водой: 2Na + 2H2O = 2NaOH + H2 Опыт: взаимодействие натрия с водой. Химические свойства с сложными веществами. 1) 2Na + 2HCl = 2NaCl + H 2) Na + 2HOH = 2NaOH + H 2 2 NaOH – щёлочь, твёрдое кристаллическое вещество, сильное основание. ПРИМЕНЕНИЕ Na. 1) Охладитель в ядерных реакторах в виде сплавов с калием. 2) В сплавах ( со свинцом ) для вкладышей подшипников скольжения. 3) Катализатор во многих органических синтезах. 4) Восстановитель при получения некоторых тугоплавких металлов. 5) Для получения пероксида натрия Na2O2. Вопросы по металлу натрий. 1.При взаимодействии Na + O = получится: 2 1) NaO2 2) Na2O2 3) Na2O3 4)Na2O Ответ: 2) 2.Содержание натрия в земной коре. 1)3,65% 2)2,64% 3)5,64% 4)4,25% Ответ: 2) 3.Окрашивание пламени натрия(при качественном реакции). 1)красное 2)жёлтое 3)синее 4)оранжевое Ответ: 2)