Урок 8А
реклама

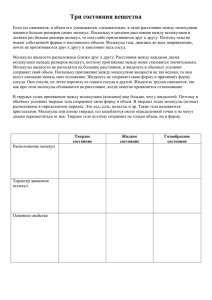
Тема урока: «Изменение агрегатных состояний вещества» Цели урока: • Обобщить различные агрегатные состояния вещества • Изучить условия протекания процессов плавления и кристаллизации вещества и связанные с ними явления • Экспериментально подтвердить изученные теоретические знания Одно и то же вещество может находиться в различных состояниях, например в твердом, жидком, газообразном: лед, вода и водяной пар. Эти состояния называют агрегатными. Вещества могут переходить из одного агрегатного состояния в другое и на практике это широко используется. Рис.1 Рис. 2 Рис. 3. Вопрос: Сможете ли вы привести примеры практического использования перехода вещества из одного агрегатного состояния в другое? Ответ: В металлургии плавят металлы, чтобы получить из них сплавы. Пар, полученный из воды при ее нагревании, используют на электростанциях, в паровых турбинах, сжиженными газами пользуются в холодильных установках и т.д. Мы живем на поверхности твердого тела – Земного шара, в сооружениях, построенных из твердых тел – домах. Наше тело, хотя и содержит приблизительно 65% воды (мозг – 80%), тоже твердое. Орудия труда, машины также сделаны из твердых тел. Знать свойства твердых тел, жидкостей жизненно необходимо. Вопрос: Каковы особенности молекулярного строения твердых тел, жидкостей и газов? Ответ: В газах при атмосферном давлении расстояние между молекулами много больше размера самих молекул. Притяжение между молекулами слабое. Движение молекул хаотичное. Газы легко сжимаемы. В жидкостях и твердых телах, плотность которых во много раз больше плотности газа. Молекулы расположены ближе друг к другу. Средняя кинетическая энергия молекул недостаточна для того, чтобы совершить работу по преодолению сил молекулярного притяжения. Поэтому молекулы в жидкостях и особенно в твердых телах не могут далеко удалятся друг от друга. Передавая телу энергию можно перевести его из твердого состояния в жидкое, а из жидкого – газообразное. Отнимая энергию (охлаждая) у газа можно получить жидкость (правда это возможно при очень низких температурах); Отнимая энергию у жидкости – получить твердое тело. Сегодня мы рассмотрим переход вещества из твердого состояния в жидкое и наоборот. Переход вещества из твердого состояние в жидкое называют плавлением. Кристаллом называют тело определенной геометрической формы, ограниченное естественными плоскими гранями. Название кристалла Алмаз Вид кристалла Форма кристалла Гранит Изумруд Кварц Турмалин Поваренная соль Правильность внешней формы кристаллических тел обусловлено тем, что частицы, из которых эти тела состоят, расположены относительно друг друга в определенном порядке, на строго определенных расстояниях друг от друга. Графит Алмаз Частицы (атомы, молекулы), вследствие теплового движения, совершают колебания около определенных точек – положений равновесия частиц. Именно эти точки (они называются узлами) и расположены в определенном порядке, и если узлы соединить прямыми линиями, то получается пространственная решетка, называемая кристаллической. Снежинки К кристаллам относятся металлы, лед, нафталин, снежинки, каменная соль, берилл, алмаз, гранат, кварц, турмалин, изумруд, кальцит. Не все твердые тела – кристаллы. Существует множество аморфных тел (от греческого слова amorphous – бесформенный). Признаком аморфного тела является неправильная форма поверхности при изломе. К аморфным телам относятся: смола, пластмасса, воск и т.д. Смола Воск Между плавлением кристаллических и аморфных тел есть существенное различие. Вопрос: Что необходимо сделать, чтобы кристаллическое тело начало плавится? Ответ: нагреть. Необходимо нагреть до определенной для каждого вещества температуры, называемой температурой плавления. Температура плавления некоторых веществ, о С (при нормальном атмосферном давлении) -259 Нафтал ин 80 Золото 1064 -219 Натрий 98 Медь 1085 Азот Ртуть Лед -210 -39 0 Олово Свинец Цинк 232 327 420 Чугун Сталь Платин а 1200 1500 1772 Цезий 29 660 Осмий 3045 Калий 63 Алюми ний Серебр о 962 Вольф рам 3387 Водоро д Кислор од Чтобы вещество расплавилось недостаточно его нагреть до температуры плавления, необходимо продолжать подводить к нему теплоту, т.е. увеличивать его внутреннюю энергию. Во время плавления температура кристаллического тела не меняется. Т.к. температура тела во время плавления остается постоянной., то средняя кинетическая энергия его молекул не изменяется. Но при превращении твердого тела в жидкость разрушается кристаллическая решетка, т.е. увеличивается потенциальная энергия молекул. Переход из твердого состояния в жидкое происходит резко. Скачком, либо жидкость, либо твердое тело. Если тело продолжать нагревать дальше, после плавления. Температура его расплава будет расти. График зависимости температуры кристаллического тела (нафталина) от времени его нагревания. Никакой определенной температуры перехода из твердого состояния в жидкое у аморфных тел не. Вопрос: Смогу ли я расплавить олово в стальной ложке? Ответ: Да, так как сталь плавится при температуре 1500 С, а олово при 232ºС. Вопрос: Можно ли расплавить олово в алюминиевой ложке? Ответ: Да, алюминий плавится при температуре 660ºС. Вопрос: Можно ли вольфрам расплавить в стальной ложке? Ответ: Нет, так как стальная ложка расплавится раньше, чем вольфрам (3387ºС). Переход вещества из жидкого состояния в твердое называют отвердеванием или кристаллизацией. Температура, при которой вещество кристаллизуется, называют температурой кристаллизации или отвердевания. Температура кристаллического тела во время отвердевания не изменяется. Итак, аморфные вещества не имеют определенной температуры плавления и отвердевания, не имеют строгого порядка в расположении молекул, в этом главное отличие аморфных тел от кристаллических. Решить задачу: В сосуде находится лед при температуре – 10º С. Сосуд поставили на горелку, которая дает в равные промежутки времени одинаковое количество теплоты. Укажите, какой график (рис. 25) соответствует описанному случаю, и в чем ошибочны остальные графики? Ответ: Средний. Верхний график соответствует телам, имеющим одинаковую удельную теплоемкость в твердом и жидком состояниях, нижний не для льда. Лабораторная работа. Определение удельной теплоты плавления поваренной соли. Цель работы: • Определить удельную теплоту плавления поваренной соли Приборы и материалы: • • • • • Весы электронные Калориметр Сосуд с водой Поваренная соль термометр Ход работы Масса пустого калориметра, mк Масса калориметра с водой, mкв Масса воды, mв Масса соли, mс Начальная температура воды, t0 Температура воды после высыпания и растворения соли, t1 Количество теплоты Qв, которое отдаёт вода Количество теплоты Qс, которое получает соль Уравнение теплового баланса На каком способе теплопередачи основано действие водяного отопления? А) На теплопроводности Б) На излучении В) На конвекции Какой дом теплее: деревянный или кирпичный, если толщина стен одинакова? А) Деревянный Б) Оба одинаково сохраняют тепло В) Кирпичный Какие вещества: вода (1), латунь (2), железо (3), шерсть (4) обладают хорошей теплопроводностью? А) 3, 2 Б) 1, 2, 3 В) 2, 3, 4 Зачем на нефтебазах баки для хранения бензина красят серебряной краской? А) С целью уменьшения испарения бензина Б) С целью уменьшения поглощения солнечных лучей и нагревания В) С целью увеличения поглощения солнечных лучей Можно ли предсказать, какое направление будет иметь ветер у моря ночью после жаркого дня? А) можно: с суши на море Б) можно: с моря на сушу В) Нельзя Нагретый медный брусок вплотную придвинули к стальному. Как изменилась внутренняя энергия брусков? А) Медного увеличилась, стального уменьшилась Б) Медного уменьшилась, стального увеличилась В) У обоих не изменилась Олово переведено из одного агрегатного состояния в другое. При этом его внутренняя энергия уменьшилась. Что произошло? А) Затвердело Б) Расплавилось В) Не изменилось Домашнее задание: Упражнение 8, №№ 1092, 1095. Итоги урока: 1. Обобщили полученные знания по теме «Тепловые явления» 2. Изучили условия протекания процессов плавления и кристаллизации вещества и связанные с ними явления 3. Экспериментально подтвердили изученные теоретические знания