теории Лэнгмюра
реклама

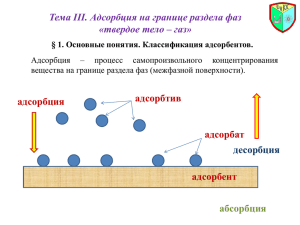
Основные положения теории мономолекулярной адсорбции Лэнгмюра 1) адсорбция протекает не на любой точке поверхности твердого тела, а только на так называемых активных центрах 2) активные центры энергетически эквивалентны (адсорбционная поверхность энергетически однородна) 3) каждый из активных центров взаимодействует только с одной молекулой адсорбата, а при полном заполнении поверхности адсорбента слоем адсорбата толщиной в одну молекулу (мономолекулярного слоя) адсорбция прекращается 4) адсорбированные молекулы не переходят от центра к взаимодействуют друг с другом внутри адсорбционного слоя центру и не 5) в состоянии адсорбционного равновесия скорости адсорбции (прямой процесс) и десорбции (обратный процесс) одинаковы десорбция адсорбция Вывод адсорбционного уравнения Лэнгмюра Определение констант в уравнении изотермы адсорбции Лэнгмюра = Анализ изотермы адсорбции по Лэнгмюру III II I I II III 1 >> KC a ≈ a∞KC ≈ KГC Область выполнения закона Генри (адсорбция по Генри) a ≈ a∞ Предельная адсорбция 1 ≈ KC 1 << KC Факторы, влияющие на молекулярную адсорбцию a = f (природа адсорбента, природа адсорбата, концентрация (парциальное давление адсорбата в фазе над твердой поверхностью), температура) a∞ = f (природа адсорбата; величина площади, занимаемой одной молекулой адсорбата на поверхности адсорбента в случае образования мономолекулярного слоя) K = f (природа адсорбата, природа адсорбента, температура) § 4. Теория полимолекулярной адсорбции БЭТ Основные положения теории БЭТ те же, что и у теории Лэнгмюра, за исключением одного отличия: при заполнении поверхности адсорбента слоем адсорбата толщиной в одну молекулу адсорбция неп прекращается, адсорбировапвшаяся молекула способна выступать в роли активного центра при адсорбции на ней следующих молекул адсорбата с образованием второго, третьего и т.д. адсорбционных слоев мономолекулярная (теория Лэнгмюра) a a∞ a a∞ C полимолекулярная (теория БрунауэраЭммета-Теллера) 1 p/pS В области образования мономолекулярного слоя величина адсорбции сущенственно замедляет ход при возрастании парциального давления адсорбата, в области давлений пара адсорбата, близких к давлению его насыщенного пара адсорбция сменяется объемной конденсации адсорбата § 4. Теория полимолекулярной адсорбции БЭТ a a C* p (1 p pS pS ) * (1 (C 1) * p если p/pS << 1, то a a pS Уравнение изотермы адсорбции Брунауэра-Эммета-Теллера ) C* p pS K*p 1 K * p 1 C * p pS С = KpS Уравнение изотермы адсорбции Лэгнгмюра если p 0, то a a K * p Уравнение изотермы адсорбции Генри Определение констант в уравнении БЭТ a a C* p (1 p pS p pS ) * (1 (C 1) * p pS ) pS a * (1 p pS ) 1 C 1 p * pS a * Ñ a * Ñ p pS a * (1 p pS ) tg 1 a * Ñ p pS C 1 a * Ñ 0.05 p pS 0.3