Энтропия
реклама

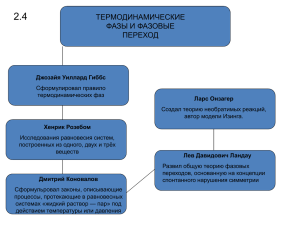
Энтропия Q dS T Приращение энтропии при переходе системы из равновесного состояния 1 в равновесное состояние 2: 2 S2 S1 1 Q T S – функция состояния (S – не зависит от вида процесса). В случае необратимого процесса вычислить S можно по любому обратимому процессу между состояниями 1 и 2. Свойства энтропии 1) Энтропия – функция состояния 2) Энтропия – аддитивная величина 3) Энтропия замкнутой (теплоизолированной) макросистемы не уменьшается: - в случае обратимых процессов S не изменяется - в случае необратимых процессов S возрастает. 1) Теорема Нернста (III начало термодинамики) При T 0 S0 Вычисление энтропии 1) Q dU A cV dT pdV dV cV dT RT V dT RdV dS cV (1) T V 2) ln ln R ln T ln p ln V dT dp dV T p V dp dV dS cV cp (2) p V Вычисление приращения энтропии Приращение энтропии при необратимом процессе между двумя равновесными состояниями 1 и 2 можно вычислить по любому обратимому процессу. Пример: Расширение газа в пустоту A 0; U 0; T1 T2 Вычислим S по изотермическому процессу: S Q T pdV T V1 V2 S R ln V1 V2 V1 R V dV Статический вес (термодинамическая вероятность) - число различных микросостояний, соответствующих данному макросостоянию. Пример: А 1 2 3 4 1 2 3 4 В Вероятность состояния Pi (Pi=1) 1234 1 1/16 234 134 124 123 4 4/16 А 1 2 3 4 12 13 14 23 24 34 В Вероятность состояния Pi (Pi=1) 1234 1 1/16 4 4/16 6 6/16 234 134 124 123 34 24 23 14 13 12 Формула Больцмана S k ln Пример: Мгновенное расширение газа от V1 до V2 0 V1 V2 V0 V1 1) P1 V0 N (1) N – число молекул 2) A 0; U 0 По изотермическому процессу вычислим: N V2 V2 V2 P2 S R ln kN ln k ln k ln V1 V1 P1 V1 2 S k ln S k ln 1 Неравенство Клаузиуса 2 Q T 0 dQ 1 T dS - для кругового процесса = обратимый процесс < необратимый процесс Объединённая запись первого и второго начала термодинамики: TdS Q dU A Тепловые двигатели Нагреватель Рабочее вещество Холодильник A=Qн-Qх Qн Q х Qн Цикл Карно p T Tн Qн Tх Qх V Обратимый цикл 1 2 4 3 S1 S2 S Qнагр T1 ( S2 S1 ) Q холод T2 ( S2 S1 ) Qн Q х T1 T2 Qн T1