Физическая химия - Кафедра неорганической, физической и
реклама

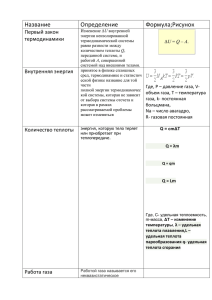
Физическая химия Лектор: Андрей Владимирович Погребняк Лекция №1 ПЛАН ЛЕКЦИИ • Предмет физической химии • Основные понятия химической термодинамики • Нулевой закон и первое начало термодинамики • Второе и третье начала термодинамики • Теплота растворения и гидратации • Энтропия ФИЗИЧЕСКАЯ ХИМИЯ (определение) Физическая химия представляет собой науку, которая объясняет химические явления и устанавливает их закономерности на основе общих принципов физики ФИЗИЧЕСКАЯ ХИМИЯ (разделы, важные для фармации) • Химическая термодинамика • Фазовые равновесия и учение о растворах • Электрохимия • Химическая кинетика и катализ • КОЛЛОИДНАЯ ХИМИЯ (осенний семестр) Вехи истории физической химии Термин "физическая химия" принадлежит М.В. Ломоносову, который в 1752 впервые прочитал студентам Петербургского университета курс «Физической химия». Ему принадлежит след. определение: "Физическая химия есть наука, объясняющая на основе положений и опытов физики то, что происходит в смешанных телах при химических операциях". Вехи истории физической химии В 1887 г. Оствальд был назначен первым профессором физической химии в Лейпцигском университете, где в числе его ассистентов и коллег работали Якоб Вант-Гофф, Сванте Аррениус и Вальтер Нернст. В этом же году Оствальд основал «Журнал физической химии» ("Zeitschrift für physikalische Chemie") Деятельность провизора Соответствующие разделы физической химии или физикохимические методы анализа Извлечение лекарственных веществ из растительного и животного сырья Учение о химическом равновесии, химическая кинетика и катализ Учение о фазовом равновесии, (экстрагирование), учение о растворах, учение о диффузии Приготовление лекарственных препаратов и лекарственных форм Свойства дисперсных систем, фазовые поверхностные явления, свойства растворов и др. Промышленное производство лекарственных веществ Определение физической совместимости лекарственных веществ Анализ лекарственных веществ в субстанции, в лекарственных формах, в природных объектах, в экстрактах равновесия, Фазовые и химические равновесия, растворы, термический анализ Физико-химические методы анализа: оптические спектрофотометрия, фотоколориметрия, нефелометрия, турбидиметрия и т. д.; электрохимические потенциометрическое, кондуктометрическое, амперометрическое титрование, полярография и т.д. хроматографические - адсорбционная, распределительная хроматография, колоночная, тонкослойная, бумажная, электрофоретическая хроматография и др. Определение и продление сроков годности лекарственных Кинетика, катализ, фотохимия препаратов Учение о растворах (осмос, взаимная растворимость веществ), Выбор способа введения лекарств в организм человека учение о фазовом равновесии (экстракция, распределение, диффузия), кислотно-основный катализ, кинетика, свойства дисперсных систем Исследование поведения лекарственных веществ в организме Диффузия, свойства гелей, свойства поверхностно--активных и высокомолекулярных веществ, кинетика, учение о растворах, учение о химическом равновесии и др. Химическая термодинамика изучает законы, которым подчиняются энергетические превращения, сопровождающие химические процессы, возможность, протекания она позволяет направление химических различных условиях. определить и реакций предел при ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ • Система – совокупность веществ (компонентов) в указанном фазовом состоянии, находящихся во взаимодействии и отделённых от окружающей среды граничной поверхностью • Гомогенной называется однородная с., внутри которой нет поверхности раздела между частями системы с различными свойствами (ж. или тв. растворы, сухие газовые смеси) • Гетерогенные с. имеют поверхности раздела между частями с различными свойствами и состоят из двух или более фаз. ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ • Фаза – совокупность всех гомогенных частей системы, одинаковых по химическому составу, структуре и по всем интенсивным свойствам и отделённых от других частей поверхностью раздела • Компонент – самостоятельно существующее химическое соединение, входящее в состав фазы • Открытая система • Закрытая система • Изолированная система ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ • Экстенсивные свойства зависят от количества вещества (объем, теплоёмкость, энтропия) • Интенсивные свойства не зависят от количества вещества (плотность, температура) • Функции состояния – свойства, которые зависят от начального и конечного состояния и не зависят от пути перехода. ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ • Внутренняя энергия (U) – функция состояния, характеризующая общий запас энергии системы • Работа (W) – макроскопическая форма передачи энергии (в форме кинетической энергии направленного движения частиц) • Теплота (Q) – передача энергии путём столкновения молекул (теплообмена). Микроскопическая (неупорядоченная) форма передачи энергии. ТЕПЛОТА И РАБОТА ЯВЛЯЮТСЯ ФУНКЦИЯМИ ПРОЦЕССА! ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ • Самопроизвольные и несамопроизвольные процессы • Изотермические (T=const), изобарные (p=const) и изохорные (V=const) процессы • Процесс без теплообмена с окружающей средой – адиабатический • НУЛЕВОЙ ЗАКОН ТЕРМОДИНАМИКИ • 1931 г. Фаулер СЛИ СИСТЕМЫ «А» И «В» КАЖДАЯ НАХОДЯТСЯ В ТЕПЛОВОМ РАВНОВЕСИИ С СИСТЕМОЙ «С», ТО МОЖНО УТВЕРЖДАТЬ, ЧТО «А» И «В» НАХОДЯТСЯ В ТЕПЛОВОМ РАВНОВЕСИИ ДРУГ С ДРУГОМ Данный постулат лежит в основе измерений температуры ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ (ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ) 1640 Рене Декарт, 1686 Готфрид Лейбниц, 1836 Герман Гесс и др. Энергия не творится из ничего и не исчезает бесследно, а только превращается из одной формы в другую в эквивалентных количествах ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ (ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ) U = Q W Однако в любой изолированной системе общий запас энергии сохраняется постоянным, т.е. при Q = 0 и w = 0 U = const и U = 0 ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ (ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ) • Если система не совершает работы, то любое изменение внутренней энергии осуществляется только за счёт поглощения или выделения теплоты, т.е. при w = 0 U = Q • Если система не получает и не отдаёт теплоты, то совершаемая ею работа производится только за счёт убыли внутренней энергии, т.е. при Q = 0 U = w или w = U - отсюда следует, что невозможно создать вечный двигатель (механизм) бесконечно долго производящий работу без притока энергии извне ЭНТАЛЬПИЯ w = рV (для изобарного процесса) и значит U = Qр рV Так как p и V - параметры состояния, а U - функция состояния, то сумма U + рV = Н тоже является функцией состояния. Эта функция называется энтальпией УРАВНЕНИЕ МЕНДЕЛЕЕВА-КЛАПЕЙРОНА Между изменением энтальпии и изменением внутренней энергии системы существует взаимосвязь, выражаемая уравнениями: Н = U + nRT или U = Н nRT но pV = nRT , откуда pV = nRT ТЕРМОХИМИЯ • Раздел х.т., изучающий тепловые эффекты, сопровождающие химические процессы (химические реакции) • Задачи термохимии: изучение тепловых эффектов химических реакций и теплоёмкости веществ ТЕРМОХИМИЯ (основные понятия) • Теплота образования Hf (от formation - образование) • Теплота сгорания Hс (от combustion - сгорание) • Стандартные условия (1 атм = 101325 Па), 298 К (25оС) • ЕСЛИ термохимическая или термодинамическая величина приведена для стандартного состояния, то это отмечается знаком « о »: Hоf ; Hoс ; Uо ТЕРМОХИМИЯ Тепловым эффектом называется количество тепла выделяемого или поглощаемого при необратимом проведении реакции Основной закон термохимии – закон #Гесса, Германа Ивановича (1840) ЗАКОН ГЕССА • Тепловой эффект реакции не зависит от пути его протекания (или числа стадий), а зависит лишь от начального и конечного состояния исходных веществ и продуктов ПЕРВОЕ СЛЕДСТВИЕ ЗАКОНА ГЕССА •тепловой эффект разложения сложного вещества на более простые численно равен, но противоположен по знаку тепловому эффекту образования этого сложного вещества из более простых CaСО3 (T) = СO2 (г) + CaO(т) + Н1 ВТОРОЕ СЛЕДСТВИЕ ЗАКОНА ГЕССА • Если совершаются две реакции, приводящие из различных начальных состояний к одинаковым конечным, то разность между их тепловыми эффектами равна тепловому эффекту реакции перехода от одного начального состояния к другому начальному С(гр) + О2 = CO2 393,51 кДж/моль С(алм) + О2 = CO2 395,39 кДж/моль ТРЕТЬЕ СЛЕДСТВИЕ ЗАКОНА ГЕССА • Если совершаются две реакции, приводящие из одинаковых начальных состояний к различным конечным, то разность между их тепловыми эффектами равна тепловому эффекту реакции перехода из одного конечного состояния к другому конечному С(гр) + О2 CO2 393,505 кДж/моль CO + 1/2 O2 CO2 282,964 кДж/моль С(гр) + 1/2 O2 CO + Hr Hr = 393,505 (282,964 ) = 110,541 кДж/моль. ЗАЧЕМ НАМ ВСЁ ЭТО???!!! ТЕРМОХИМИЧЕСКОЕ УРАВНЕНИЕ С(графит) + 1/2 О2 (г) = CO (г) + Hr ; Hr = 110, 54 кДж/моль Четвёртое следствие закона Гесса Hr = (niHf i) прод (niHf i) исх Пятое следствие закона Гесса Hr = (niHc i) исх (niHc i) прод ТЕПЛОТА РАСТВОРЕНИЯ Теплота растворения 1 моля вещества с образованием бесконечно разбавленного раствора называется интегральной теплотой растворения ТЕПЛОТА РАСТВОРЕНИЯ Интегральная теплота растворения кристаллических веществ складывается из двух величин – теплоты разрушения кристаллической решётки Нреш и энтальпии гидратации высвобождаемых при диссоциации ионов Нрр = Нреш + Нгидр ТЕПЛОТА НЕЙТРАЛИЗАЦИИ тепловой эффект взаимодействия эквивалента кислоты с эквивалентом основания Н+ + ОН = Н2О + Ннейтр для любых сильных кислот и сильных оснований имеет одно и то же значение 55,81 кДж/моль при 298К ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ • Теплота не может самопроизвольно передаваться от более холодного тела к более горячему • Энергия различных видов стремится перейти в теплоту, а теплота стремится рассеяться Однако рассеяние энергии среди компонентов системы может быть вычислено методами статистической термодинамики ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ S = k lnW (Больцман, 1872) о S r = ( o ni S i) прод (ni o S )I исх Постоянная Больцмана S = k lnW, где S – макроскопическое состояние (общая энтропия) W – число микроскопических состояний (термод. вероятность) k=R/NA , k= -23 1,38*10 ТРЕТЬЕ НАЧАЛО ТЕРМОДИНАМИКИ При абсолютном нуле температуры энтропия любого вещества в виде идеального кристалла равна нулю ТРЕТЬЕ НАЧАЛО ТЕРМОДИНАМИКИ для идеально упорядоченного кристалла при абсолютном нуле температуры, когда тепловое движение частиц отсутствует, термодинамическая вероятность W равна 1. Значит, в соответствии с уравнением Больцмана, его энтропия равна нулю: S0 = k ln 1 = 0 V = const, Т = const – изохорно-изотермический процесс A = U-TS свободная энергия при постоянном объёме энергия Гельмгольца p = const, Т = const – изобарно-изотермический процесс G = H-TS свободная энергия при постоянном давлении энергия Гиббса Величина энергии Гельмгольца (в изохорных условиях) и энергии Гиббса (в изобарных условиях) указывает направление самопроизвольного процесса. ПРОЦЕСС ВОЗМОЖЕН, ЕСЛИ G 0 и А 0 СОСТОЯНИЕ РАВНОВЕСИЯ, ЕСЛИ G = 0 и А = 0 ДЛЯ ПРАКТИЧЕСКИХ РАСЧЕТОВ о А о U о Т S = о о о G = Н Т S ДЛЯ ПРАКТИЧЕСКИХ РАСЧЕТОВ о G r = о (niG f i) прод о А = о G о (ni G f i) исх nRT Зависимость теплового эффекта реакции от температуры описывается законом Кирхгоффа «Температурный коэффициент теплового эффекта процесса равен изменению теплоёмкости системы, происходящему в результате процесса» ТЕПЛОЕМКОСТЬ Отношение сообщённого телу тепла к приращению его температуры С, [Дж/К] Если Cр r = (niСр i) прод (ni Ср i) исх Уравнение Кирхгоффа Н2 = Н1 + Cр r(Т2 Т1) (для малого интервала температур) - ХИМИЧЕСКОЕ РАВНОВЕСИЕ 1. Термодинамический признак равновесия (энергии Гиббса и Гельмгольца не изменяются) 2. Кинетический признак равновесия (скорости прямой и обратной реакций одинаковы) ЗАДАЧИ: оптимизация состава равновесной смеси веществ; расчёт равновесного выхода продуктов химической реакции ЗАКОН ДЕЙСТВУЮЩИХ МАСС (концентраций) Вааге и Гульдберг (1865), Вант-Гофф (1880) aA + bB dD + eE vпр = kпр САа СВb vобр = kобр СDd Сee kпр СDd CЕ e vпр = vобр = Kc = , kобр СAa CBb ЗАКОН ДЕЙСТВУЮЩИХ МАСС d аD аЕ Ка = . a b аA аB e ЗАКОН ДЕЙСТВУЮЩИХ МАСС d рD рЕ Кр = . a b рA рB e СВЯЗЬ МЕЖДУ Кс и Кр n (RT) n Кр(RT) Кр = Кс или Кс = n = ni прод (г) ni исх (г) Если n = 0 тогда Кр = Кс ЗАДАЧА! Расчёт равновесного выхода продуктов реакции Принцип Ле-Шателье ЕСЛИ СИСТЕМА НАХОДИТСЯ В СОСТОЯНИИ РАВНОВЕСИЯ, ТО ПРИ ДЕЙСТВИИ НА НЕЁ СИЛ, ВЫЗЫВАЮЩИХ НАРУШЕНИЕ РАВНОВЕСИЯ, СИСТЕМА ПЕРЕХОДИТ В ТАКОЕ СОСТОЯНИЕ, В КОТОРОМ ЭФФЕКТ ВНЕШНЕГО ВОЗДЕЙСТВИЯ ОСЛАБЕВАЕТ Принцип Ле-Шателье определяет смещение химических и фазовых равновесий при изменении температуры, давления или состава системы Уравнения изотермы химической реакции Якоб Вант-Гофф (1852-1911) (ученик Фридриха Кекуле) «ФАНТАСТИЧЕСКАЯ ЧЕПУХА!» Адольф Кольбе «Поживемувидим…» Уравнения изотермы химической реакции o G = RT ln K r p o А = RT ln K r с ФАЗОВОЕ РАВНОВЕСИЕ Основные фазовые переходы: плавление (отвердевание) испарение (конденсация паров) возгонка (сублимация) растворение (кристаллизация) ОСНОВНЫЕ ПОНЯТИЯ • Фаза – совокупность всех гомогенных частей системы, одинаковых по химическому составу, структуре и по всем интенсивным свойствам и отделённых от других частей поверхностью раздела • Компонент – самостоятельно существующее химическое соединение, входящее в состав фазы • Поверхность раздела (межфазная граница) ПРАВИЛО ФАЗ ГИББСА С=КФ+n где С – вариантность системы (число внешних условий, которые можно менять, не изменяя при этом числа фаз в системе); n – число факторов, определяющих состояние. ПРАВИЛО ФАЗ ГИББСА С = 0 - система называется нонвариантной; изменение любого параметра состояния приводит к изменению числа фаз. С = 1 - система называется моновариантной; только один из параметров может быть изменён без изменения числа фаз. С = 2 - система называется бивариантной. ФАЗОВАЯ ДИАГРАММА графическое изображение всех возможных фазовых состояний термодинамической системы в пространстве основных параметров состояния – температуры и/или давления Линии равновесия на Ф.Д. разделяют фазовые поля Для фазовых полей С=КФ+2=11+2=2 Для линий равновесия С=КФ+2=12+2=1 Для тройной точки С=КФ+2=13+2=0 РАСТВОРЫ 1. Термодинамически устойчивые гомогенные молекулярнодиспесные системы 2. Однофазные системы переменного или гетерогенного состава, состоящие из двух или более компонентов. Как правило выделяют растворитель и растворенное вещество. Основные виды – растворы неэлектролитов и растворы электролитов. ЭТО РАСТВОР? НЕТ! РАСТВОРЫ РАСТВОРЫ Идеальные и реальные. Способы выражения концентрации растворов: Массовая доля i Объёмная доля i Молярная (мольная) доля Хi (иногда обозначают Ni ) Молярная концентрация С Моляльная концентрация mi Двухкомпонентные системы Если в растворе половина молекул воды, а половина молекул любого нелетучего вещества, то давление пара воды над раствором вдвое меньше, чем над чистой водой. Закон Рауля Давление пара компонента над раствором пропорционально его молярной доле в растворе pA = ХA poA pВ = ХВ poВ Относительное понижение давления пара растворителя над раствором равно молярной доле растворённого вещества p A pA = ХB , o pA o Коллигативность Относительное понижение давления пара растворителя не зависит от природы растворителя и поэтому относится к коллигативным свойствам растворов (свойствам, которые зависят только от концентрации компонентов) Закон Дальтона Общее давление пара над раствором равно сумме парциальных давлений компонентов p = p A + pB o o p = ХA p A + ХB p B Диаграмма «давление-состав» Рауль Дальтон Отклонения от закона Рауля Положительное (ацетон дисульфид углерода) Отрицательное (вода этанол) Первый закон Коновалова Жидкости закипают тогда, когда давление пара над ними становится равным атмосферному давлению. Чистые жидкости кипят при постоянной температуре (Ткип) В растворах иначе: Насыщенный пар по сравнению с равновесным раствором относительно богаче тем компонентом, добавление которого к системе повышает полное давление пара. Пар в равновесной бинарной системе по сравнению с жидкостью обогащён легкокипящим компонентом. Диаграмма кипения бинарной смеси коннода ПАР начало кипения ЖИДКОСТЬ состав пара Второй закон Коновалова Экстремумы на диаграмме кипения отвечают такому равновесию раствора и насыщенного пара, при котором составы обеих фаз одинаковы Азеотропными растворами называют растворы, которые при определённом соотношении компонентов, имеют состав пара одинаковый с составом жидкости (т.е. смесь ведёт себя как чистое вещество). Диаграмма кипения азеотропной смеси Виды азеотропных смесей С минимумом Ткип азеотропной смеси H2O C2H5OH 100 78,3 78,15 С максимумом Ткип азеотропной смеси H2O HNO3 100 86 120,5 68 ПЕРЕГОНКА Это группа методов разделения жидких смесей, основанных на различии составов жидкости и образующегося из неё пара. В фармацевтической технологии используется для очистки и разделения жидкостей. КАК ЭТО РАБОТАЕТ? ВИДЫ ПЕРЕГОНКИ 1. Простая 2. Фракционная 3. Ректификационная Ректификационая колонна в разрезе Разделение азеотропных смесей 1. Перегонка при давлении, отличающемся от атмосферного 2. Химическое связывание 3. Образование тройных азеотропов ОГРАНИЧЕННО РАСТВОРИМЫЕ ЖИДКОСТИ Рассматриваются на примере построения и анализа диаграммы состояния системы «фенол-вода» (практическое занятие) Перегонка с водяным паром Расчёт коэффициента расхода пара По закону Дальтона: Так как: То: po A nA = , po B nB mA mB nA = и nA = MA MB poA MA mA = poB MB mB mН2О poН2О MН2О = mk pok Mk