Слайд 1 - ОШ №5 г.Константиновки
реклама

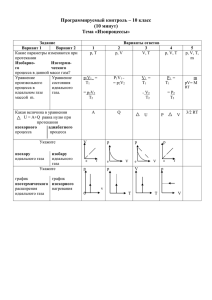
Бенуа́ Поль Эми́ль Клапейро́н • (1799-1864) • Воспитывался в парижской политехнической школе (1816— 1818). В 1820 отправился со своим товарищем Ламе в Россию, где был профессором в институте путей сообщения. Вернувшись в 1830 во Францию, Клапейрон участвовал в постройке многих железных дорог и составил множество проектов по постройке мостов и дорог. • В 1858 был избран в члены парижской академии наук на место Коши. Одна из улиц Парижа получила его имя. Его имя также внесено в список величайших учёных Франции, помещённый на первом этаже Эйфелевой башни. Дми́трий Ива́нович Менделе́ев • русский учёный-энциклопедист, общественный деятель. Химик, физикохимик, физик, метролог, экономист, технолог, геолог, метеоролог, педагог, воздухоплаватель, приборостроитель. Профессор Санкт-Петербургского университета; член-корреспондент по разряду «физический» Императорской Санкт-Петербургской Академии наук. Среди наиболее известных открытий — периодический закон химических элементов, один из фундаментальных законов мироздания, неотъемлемый для всего естествознания. Роберт Бойль Роберт Бойль (англ. Robert Boyle, ирл. Robaird Ó Bhaoill; 25 января 1627 — 30 декабря 1691) физик, химик и богослов, седьмой сын Ричарда Бойля, графа Коркского, вельможи времён Эдм Мариотт Эдм Мариотт (фр. Edme Mariotte; 1620, Дижон — 12 мая 1684, Париж) — аббат, французский физик XVII века, родился в Бургундии в 1620 году. Проживал вблизи Дижона и был приором в городке St. Martin sous Beaune. Mариотт был одним из основателей (1666) и первых членов Академии наук, основанной в Париже. Умер в Париже в 1684 г. Важнейшие работы Мариотта собраны в его «Essais de physique» (4 выпуска, 1676—1681); из них наиболее известен второй выпуск: «De la nature de l’air» (1679), содержащий изложение известной зависимости между упругостью газа и его объёмом; тот же закон был найден на 17 лет раньше Бойлем и обычно его называют «законом Бойля-Мариотта». Жак Александр Сезар Шарль • (фр. Jacques Alexandre César Charles, 12 ноября 1746, Божанси, Луаре — 7 апреля 1823, Париж) — французский изобретатель и учёный. Известен как изобретатель наполняемого водородом, или другим газом легче воздуха, воздушного шара, получившего по имени изобретателя название шарльер, в противоположность монгольфьеру. • Открыл названный его именем физический закон P1/T1=P2/T2 Жозеф Луи Гей-Люссак 1778 —1850 • • Закон Гей-Люссака — закон пропорциональной зависимости объёма газа от абсолютной температуры при постоянном давлении, названный в честь французского физика и химика Жозефа Луи Гей-Люссака, впервые опубликовавшего его в 1802 году. Следует отметить, что в англоязычной литературе закон Гей-Люссака обычно называют законом Шарля и наоборот. Кроме того, законом Гей-Люссака называют также химический закон объёмных отношений. Уравнение состояния идеального газа • (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид: где P — давление, M— молярный объём, R— универсальная газовая постоянная T — абсолютная температура,К Дж R 8,31 моль К Закон Бо́йля — Марио́тта Закон Бо́йля — Марио́тта — один из основных газовых законов, открытый в 1662 году Робертом Бойлем и независимо переоткрытый Эдмом Мариоттом в 1676 году. Закон является частным случаем уравнения состояния идеального газа. Закон Бойля — Мариотта гласит: При постоянной температуре и массе идеального газа произведение его давления и объёма постоянно В математической форме это утверждение записывается следующим образом pV = const, где p — давление газа; V — объём газа. R 8,31 Дж моль К ν — количество вещества, m — масса, M— молярная масса уравнение состояния можно записать: Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака: Изотермический процесс • определение: для газа данной массы произведение давления на объем постоянна, если температура газа не меняется.- закон Бойля – Мариотта. • - изотерма, изображает обратно пропорциональную зависимость, график находится в первой четверти т.к. величины p,V положительны. Изобарный процесс (процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении). Определение: для газа данной массы отношение объема к температуре постоянно, если давление не изменяется. прямолинейная зависимость.- закон Гей-Люссака (1802г) Изохорный процесс • (процесс изменения состояния термодинамической системы при постоянном объеме). • Определение: при данной массе газа отношение давление газа к температуре постоянно, если объем газа не изменяется.- закон Шарля (1787г.) Вывод: изохора соответствующая большему объему лежит ниже изохоры, соответствующей меньшему объему . Построим графики в координатах PV, VT, Pt. Решение задач Решение задач Решение задач Решение задач Решение задач Решение задач Использованные ресурсы: http://ru.wikipedia.org/wiki ОШ №5 Учитель Якубец И.В.