Эмпирические газовые законы (1)
реклама

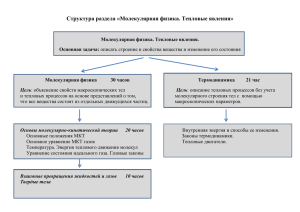
Термодинамические параметры I. Давление газа: F p S Н p м2 Па F - суммарная сила, действующая по нормали к поверхности S - площадь поверхности II. Объём газа: V V м3 III. Абсолютная температура: T T К T t 273,15 K 1C 1K Эмпирические газовые законы (1) Изопроцессы – процессы, протекающие в системе с постоянной массой газа при каком-либо фиксированном термодинамическом параметре. I. p=const Закон Гей-Люссака: V V0 (1 V t C ) , где V V0 ( t 0C ) температурный коэффициент объемного расширения: V 1 V 1 V0 T V 273 Эмпирические газовые законы (2) II. V=const Закон Шарля: p p0 (1 p t C) , где p p0 ( t 0C ) температурный коэффициент объемного расширения: p 1 p 1 p0 T V 273 III. T=const Закон Бойля-Мариотта : pV const Закон Авогадро Равные объёмы различных газов при одинаковых давлениях и температурах содержат одно и то же число молекул. Количество вещества N m NA M N A - число Авогадро М - молярная масса моль 1 N A 6,02 10 моль 23 Уравнение Менделеева-Клапейрона m PV RT M P V m M T R уравнение состояния идеального газа - давление газа - объём газа - масса газа - молярная масса газа - абсолютная температура газа - универсальная газовая постоянная Дж R kN A R 8,31 моль К P, V, T – параметры состояния системы Закон Дальтона pсмеси p i i Давление смеси газов равно сумме их парциальных давлений. pi - парциальное давление – давление, которое данный газ создавал бы в отсутствие остальных pi ni kT nсмеси kT pсмеси i i Получим связь давления идеального газа с его концентрацией и температурой m RT NA p kT nkT M V V n n - концентрация газа k - постоянная Больцмана Количество вещества смеси газов смеси i i - количество вещества газов, входящих в состав смеси Молярная масса смеси газов смеси m i i i i m i i mi i i Основное уравнение МКТ Nx 1 nSvt 6 Основное уравнение МКТ Основное уравнение МКТ Средняя сила, действующая на стенку со стороны одной молекулы: Fx vx 2m0v m0 t t Число ударов молекул о стенку за время t: Nx Давление газа: Fx N x p S 1 nSvt 6 2 m v 1 2 0 2 nm0v n 3 3 2 2 n пост 3 пост - средняя кинетическая энергия поступательного движен одной молекулы Физический смысл температуры T Уравнение Менделеева-Клапейрона: pV RT Основное уравнение кинетической теории газа: 2 p n 3 1 пост N 2 RT N NA 3 1 пост 1 пост 3 R 3 T kT 2 NA 2 k 1, 38 10 23 Дж К