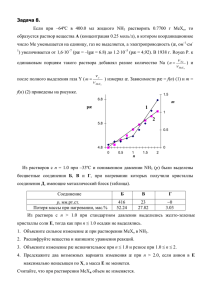
NH 3
реклама

Девиз урока «Я думаю, что химики – это те, кто на самом деле понимает мир. Этот огромный мир – удел химиков» (Л. К. Полинг) «Можно не любить химию, но прожить без неё сегодня и завтра нельзя» (О.М. Нефёдов) Связано с названием оазиса бога Амона в Северной Африке, находящемуся на перекрестке караванных путей. По некоторым другим сведениям, современное название произошло от древнеегипетского слова «амониан». Так называли всех верующих людей, поклоняющихся богу Амону NH3 Сокращенное название «аммиак» которым мы всегда пользуемся, ввел в обиход в 1801 году русский ученый-химик, академик Яков Дмитриевич Захаров, который впервые разработал также и систему русской химической номенклатуры. Я.Д.Захаров 1781-1852 гг. NH3 Аммиак был получен в чистом виде в 1774 г. английским химиком Джозефом Луи Пристли. Он нагревал аммониак (хлорид аммония) с гашеной известью (гидроксид кальция). 1711-1794 г. NH3 NH3 Н :N:Н Н : : Н :N + H Н Связи N-H полярные, общие электронные пары смещены в сторону атома азота как атома с большей ЭО. ЭО (Н)=2,1 ЭО (N)=3,5. ЭО = 1,4 связь ковалентная полярная Молекула полярная. Азот с водородом образует 3 ковалентные связи по обменному механизму Газ, легче воздуха в 1,7 раза NH3 NH3 Р – высокая H2O 1 V : 700 V, Ц Молекулярная кристаллическая решетка Кроме того, сжиженный аммиак при испарении поглощает тепло, при соприкосновении с кожей возникает обморожение различной степени Резкий запах. ТОКСИЧЕН По физиологическому действию на организм относится к группе веществ удушающего действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени. Следовательно, если чувствуется запах аммиака, то работать без средств защиты уже опасно. Техногенные катастрофы NH 3 Получение NH3 В лаборатории NH4Cl NH3 Ca(OH)2 t 2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 2H2O 1.Взаимодействие с водой. Действие водного раствора аммиака на индикаторы. 2.Взаимодействие с кислотами 3.Окисление: • без катализатора; • с катализатором; 4. Качественная реакция с солями меди, кобальта с образованием комплексного соединения NH3 NH3 Аммиак реагирует с водой, образуя гидроксид аммония (аммиачная вода, нашатырный спирт): NH3 + H2O =NH4OH Изменяет окраску индикаторов: Фенолфталеин (б/цв) малиновый Лакмус становится(фиолетовый) синим Гидроксид аммония проявляет все свойства щелочей !!! Взаимодействие с кислотами NH3 + HCl → NH4Cl хлорид аммония (нашатырь) 2 NH3 NH3 + H2SO4 → (NH4)2 SO4 сульфат аммония Дым без огня ?! (Образуется за счет образования хлорида аммония) NH3 В реакции горения аммиак проявляет восстановительные свойства 1. В отсутствии катализатора -3 +1 0 0 +1 -2 N H 3 + O 2 → N 2 + H 2O 4NH3 + 3O2 = 2N2 + 6H2O 2. Горение аммиака С КАТАЛИЗАТОРОМ. -3 +1 0 +2 -2 +1 -2 N H 3 + O 2 → N O + H 2O 4NH3 + 5O2 = 4NO + 6H2O NH3 Три связи образованы по обменному механизму четвертая – по донорно-акцепторному. Донор - молекула или ион, имеющие свободную пару электронов. Акцептор - молекула или ион, имеющие свободную орбиталь. H+ + H •+• +++++H • N H H + Чтоб продукты не пропали Вам поможет аммиак, И растениям, конечно, Аммиак совсем не враг. Если обморок случился – Может в чувство привести, Вывести из опьяненья, Глянец окнам навести. Применение аммиака Лекарства (медицина) Окислитель ракетного топлива Соли аммония для паяния NH3 Получение соды Холодильные установки Аммиак Азотная кислота Обработка драгоценных металлов Удобрения Производство взрывчатых веществ Сульфат аммония (NH4)2SO4 Хлорид аммония NH4Cl Карбамид (мочевина) CO(NH2)2 Проверь себя ? Для аммиака характерны свойства: 1 NH3 Аммиак взаимодействует с: 2 Ошибка кислот Ошибка солей щелочами Ошибка Правильно! кислотами Правильно! оснований оксидов Ошибка неметаллами Ошибка металлами Ошибка Цвет лакмуса в растворе аммиака: 3 фиолетовый Ошибка бесцветный Ошибка Аммиак – 4 восстановитель в реакции красный Ошибка С кислотами Ошибка с неметаллами Ошибка Правильно! синий С оксидами Правильно! металлов С металлами Ошибка Ответы 1. оснований 2. 3. 4. кислотами синий С оксидами металлов NH3