Теории строения атома
реклама

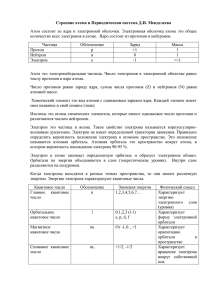
Атом (от греч. ἄτομος atomos – неделимый) Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами. По-видимому, первыми начали проповедовать атомистическое учение философ Левкипп с острова Милет в 5 в. до н.э. и его более известный ученик Демокрит из Абдеры Кусочки материи. Демокрит (460-370 до н.э.) полагал, что свойства того или иного вещества определяются формой, массой, и пр. характеристиками образующих его атомов. У огня атомы остры, поэтому огонь способен обжигать, у твёрдых тел они шероховаты, поэтому накрепко сцепляются друг с другом, у воды — гладки, поэтому она способна течь. Модель атома Томсона (модель «Пудинг с изюмом»). Джозев Джонс Томсон в 1904 г. предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами, расположенных в одной плоскости и образующих концентрические полосы. ...атомы элементов состоят из нескольких отрицательно заряженных корпускул, заключённых в сферу, имеющую однородно распределённый положительный электрический заряд... С этой новой моделью Томсон отказался от своей более ранней гипотезы «туманного атома» (nebular atom), представлявшей атом состоящим из нематериальных вихрей. • Ранняя планетарная модель атома Нагаоки. В 1904 году японский физик Хантаро Нагаока предложил модель атома, построенную по аналогии с планетой Сатурн. В этой модели вокруг положительного ядра, занимающего основную часть объема, вокруг которого по орбитам вращались электроны, объединённые в кольца. • Научная общественность не обратила внимание на эту работу Нагаоки. • Нагаока отказался от неё в 1908 году, но два следствия из нее оказались верными: • ядро атома действительно очень массивно; • электроны удерживаются на орбите благодаря электростатическим силам (подобно тому, как кольца Сатурна удерживаются гравитационными силами). В 1910 году английский физик Эрнст Резерфорд со своими учениками Гейгером и Марсденом провели эксперимент, который дал результаты, необъяснимые с точки зрения модели Томсона. В то время уже была открыта радиоактивность. Радиоактивные вещества способны испускать не только лучи высокой энергии, но и частицы высокой энергии, которые способны проникать сквозь многие предметы. Такие частицы называются альфа-частицами. Поток альфа-частиц (ядра атома гелия), возникающих при распаде натрия, направлялся на тонкую золотую фольгу толщиной приблизительно 10000 атомов, а затем становился видимым на экране со светящимся покрытием из свинцового цинка. Масса альфа-частиц в 8000 раз больше массы электрона. Скорость альфачастиц около 15000 км/сек Обнаружилось, что не все альфа-частицы проходят фольгу насквозь по прямой траектории. Некоторая их часть заметно отклонялась в сторону и даже отражалась от тонкого листа золотой фольги. Это могло означать только одно: атомы золота не сплошные, а состоят из "разреженных" пустот (сквозь которые альфа-частицы проходят беспрепятственно) и очень плотных областей, от которых альфа-частицы отскакивают, как мячик. Резенфорд понял, что такое отклонение возможно лишь при встрече с положительно зараяженной частицей большой массы. Малая вероятность отклонения на большие углы говорила о том, что эта положительная частица имеет малые размеры ~10-14 м. Эрнест Резерфорд(1871-1937) Английский физик. Один из основателей учения о радиоактивности, ядерной физики и представлений о строение атомов. Ввел понятие «период полураспада». Изучил рассеяние а - частиц и предложил планетарную(ядерную) модель атома. • В 1911 году Резерфорд в своём докладе «Рассеяние α- и β-лучей и строение атома» в философском обществе Манчестера заявил: Рассеяние заряженных частиц может быть объяснено, если предположить такой атом, который состоит из центрального электрического заряда, сосредоточенного в точке и окружённого однородным сферическим распределением противоположного электричества равной величины. При таком устройстве атома α- и β-частицы, когда они проходят на близком расстоянии от центра атома, испытывают большие отклонения, хотя вероятность такого отклонения мала. • Резерфорд предположил, что атом золота состоит из плотного, положительно заряженного ядра, в котором сосредоточена практически вся масса атома, и окружающих это ядро электронов. Электроны вращаются вокруг ядра, образуя разреженный "электронный рой", занимая огромную по сравнению с ядром область. Альфа-частицы относительно легко проходят сквозь разреженную область, занимаемую электронами и отражаются (или отклоняются в сторону) при столкновении с плотным ядром атома. По соотношению отклоненных и не отклоненных альфа-частиц удалось рассчитать, что размеры ядра атома золота примерно в 100000 раз меньше внешних границ атома, которыми он соприкасается с другими атомами. Планетарная модель атома БораРезерфорда Атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Однако такое описание атома вошло в противоречие с классической электродинамикой. Согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а, следовательно, терять энергию. Расчёты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно (10-11 сек). Для объяснения стабильности атомов Нильсу Бору в 1913 г. пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает энергию («модель атома Бора-Резерфорда»). Согласно постулатам Бора, электрон может вращаться вокруг ядра лишь по некоторым "стационарным" орбитам, находясь на которых, он не излучает энергию. Ближайшая к ядру орбита соответствует наиболее устойчивому состоянию атома. При сообщении атому кванта энергии электрон переходит на более удалённую орбиту. Обратный переход из "возбуждённого" в "нормальное" состояние сопровождается испусканием кванта излучения. 1. Из бесконечного множества электронных орбит, допускаемых классической механикой, осуществляются только те из них, для которых момент импульса электрона относительно центра его орбиты равен целому кратному постоянной Планка Число n называется главным квантовым числом. Указанные орбиты соответствуют так называемым стационарным состояниям атома, находясь в которых атом не излучает электромагнитных волн. 2. Испускание (или поглощение) энергии происходит не непрерывно, как это принимается в обычной электродинамике, а только при переходе системы из одного «стационарного» состояния в другое. Такое излучение (или поглощение) при переходе системы из одного стационарного состояния в другое, монохроматично. Соотношение между его частотой ω и общим количеством излученной энергии ΔЕ дается равенством Здесь Еm и Еn – энергии атома в двух стационарных состояниях. Модельная теория атома Бора исходит из предположения о возможности описания движения электронов в атоме, находящемся в стационарном состоянии, на основе классической физики, на которое накладываются дополнительные квантовые условия. Динамическое равновесие системы в стационарном состоянии определяется обычными законами механики, тогда как для перехода системы между различными стационарными состояниями эти законы не действительны. Поэтому разработанные Бором представления в истории физики получили название полуклассической теории. Для атома водорода расчёты спектров на основе модели Бора дали хорошее согласие с экспериментом, но для других элементов получалось существенное расхождение с опытными данными. В 1916 г. немецкий физик Арнольд Иоганн Вильгельм Зоммерфельд уточнил модель Бора. Зоммерфельд высказал предположение, что кроме круговых, электрон может двигаться и по эллиптическим орбитам. Зоммерфельд дополнил модель побочным (орбитальным) квантовым числом (определяющим форму эллипсов) и зависимостью массы электрона от скорости. В первой половине 1920-х гг. в модель атома были добавлены ещё два квантовых числа. Немецкий физик Альфред Ланде ввёл для описания движения электрона в атоме магнитное квантовое число, а молодые физики Джордж Юджин Уленбек и Сэмюэл Абрахам Гаудсмит в 1925 г. ввели в атомную физику представление о спине электрона. В 1922 году Отто Штерн и Вальтер Герлах проделали эксперимент, в котором оказалось, что атомы серебра имеют свой момент импульса. Причём проекция этого момента импульса на ось Z оказалась равной либо некоторой положительной величине, либо некоторой отрицательной величине, но не нулю. Это невозможно объяснить орбитальным моментом импульса электронов в атоме серебра. Потому что орбитальные моменты обязательно давали бы, в том числе, и нулевую проекцию. А здесь строго плюс и минус, и в нуле ничего. Впоследствии, в 1927 г. это было интерпретировано как доказательство существования спина у электронов. В опыте Штерна и Герлаха (1922) путем испарения в вакуумной печи атомов серебра или другого металла с помощью тонких щелей формируется узкий атомный пучок (рис) Этот пучок пропускается через неоднородное магнитное поле с существенным градиентом магнитной индукции. Индукция магнитного поля B в опыте велика и направлена вдоль оси Z. С позиций классической физики, пролетевшие через магнит атомы серебра должны были образовать сплошную широкую зеркальную полосу на стеклянной пластинке. Однако атомный пучок атомов серебра расщепился на два пучка, которые напылили на стеклянной пластинке две узкие зеркальные полоски, сдвинутые симметрично вверх и вниз, но не было полоски по самому центру пластинки. Измерение этих сдвигов позволило определить магнитный момент невозбужденного атома серебра. Его проекция на направление магнитного поля оказалась равной +μБ или -μБ . То есть магнитный момент невозбуждённого атома серебра оказался строго не равным нулю. в 1925 г. Ральф Крониг (ассистент известного физика Альфреда Ланде) высказал предположение о спине как результате собственного вращения электрона. Название связано с английским словом spin, которое переводится как "кружение", "верчение". Осенью 1925 г. Дж. Уленбек и С. Гаудсмит постулировали, что электрон является носителем "собственных" механического и магнитного моментов, не связанных с движением электрона в пространстве. То есть обладает спином S = ½ ћ в единицах постоянной Дирака ћ, и спиновым магнитным моментом, равным магнетону Бора. Это предположение и было принято научным сообществом, поскольку удовлетворительно объясняло известные факты. Какова же таки физическая природа наличия у электрона спина, если она не объяснима с механической точки зрения? Ответа на этот вопрос нет. Спин вносится в виде некой дополнительной гипотезы, необходимой для согласования эксперимента и теории. Спин— собственный момент импульса элементарных частиц, имеющий квантовую природу и не связанный с перемещением частицы как целого. Спином называют также собственный момент импульса атомного ядра или атома; в этом случае спин определяется как векторная сумма (вычисленная по правилам сложения моментов в квантовой механике) спинов элементарных частиц, образующих систему, и орбитальных моментов этих частиц, обусловленных их движением внутри системы. В 1925 г. Вольфганг Паули опубликовал свою работу, содержащую формулировку принципа запрета, носящего его имя: в данном квантовом состоянии может находиться только один электрон. Паули указал, что для характеристики состояния электрона необходимо четыре квантовых числа: главное квантовое число n, азимутальное квантовое число l и два магнитных числа m и s. Принцип Паули. В атоме не может быть двух электронов, у которых значения всех квантовых чисел (n, l, m, s) были бы одинаковы, т.е. на каждой орбитали может находиться не более двух электронов (c противоположными спинами). • Главное квантовое число (n). Определяет энергетический уровень электрона, удаленность уровня от ядра, размер электронного облака. Принимает целые значения (n = 1, 2, 3 ...) и соответствует номеру периода. Из периодической системы для любого элемента по номеру периода можно определить число энергетических уровней атома и какой энергетический уровень является внешним. Пример. • Элемент кадмий Cd расположен в пятом периоде, значит n = 5. В его атоме электроны раcпределены по пяти энергетическим уровням (n = 1, n= 2, n = 3, n = 4, n = 5); внешним будет пятый уровень (n = 5). • Орбитальное квантовое число (l) характеризует геометрическую форму орбитали. Принимает значение целых чисел от 0 до (n - 1). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь особой формы. Набор орбиталей с одинаковыми значениями n называется энергетическим уровнем, c одинаковыми n и l - подуровнем. • На первом энергетическом уровне (n=1) орбитальное квантовое число l принимает единственное значение l = (n - 1) = 0. Форма обитали сферическая; на первом энергетическом только один подуровень - 1s. • Для второго энергетического уровня (n=2) орбитальное квантовое число может принимать два значения: l = 0, s - орбиталь - сфера большего размера, чем на первом энергетическом уровне; l = 1, p - орбиталь - гантель. Таким образом, на втором энергетическом уровне имеются два подуровня - 2s и 2p. • Для третьего энергетического уровня (n=3) орбитальное квантовое число l принимает три значения: l = 0, s- орбиталь - сфера большего размера, чем на втором энергетическом уровне; l= 1, p - орбиталь - гантель большего размера, чем на втором энергетическом уровне; l = 2, d - орбиталь сложной формы. Таким образом, на третьем энергетическом уровне могут быть три энергетических подуровня - 3s, 3p и 3d. Для • l=0 s- подуровень, s - орбиталь – орбиталь сфера • l=1 p- подуровень, p - орбиталь – орбиталь гантель • l=2 d- подуровень, d - орбиталь – орбиталь сложной формы F - подуровень, f – орбиталь. Семь f-орбиталей, соответствующих l = 3 (n ≥ 4), изображаются в виде граничных поверхностей G - орбиталь имеет еще более сложную форму • Магнитное квантовое число (m) характеризует положение электронной орбитали в пространстве и принимает целочисленные значения от -I до +I, включая 0. Это означает, что для каждой формы орбитали существует (2l + 1) энергетически равноценных ориентации в пространстве • Для s - орбитали (l = 0) такое положение одно и соответствует m = 0. Сфера не может иметь разные ориентации в пространстве • Для p - орбитали (l = 1) - три равноценные ориентации в пространстве (2l + 1 = 3): m = -1, 0, +1 • Для d- орбитали (l = 2) - пять равноценных ориентаций в пространстве (2l + 1 = 5): m = -2, -1, 0, +1, +2 • Таким образом, на s- подуровне - одна, на p- подуровне - три, на dподуровне - пять, на f - подуровне - 7 орбиталей. • Спиновое квантовое число (s) характеризует магнитный момент, возникающий при вращении электрона вокруг своей оси. Принимает только два значения +1/2 и –1/2 соответствующие противоположным направлениям вращения. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и электрически нейтральных нейтронов, а окружающее его облако состоит из отрицательно заряженных электронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомы классифицируются по количеству протонов и нейтронов в ядре: количество протонов определяет принадлежность атома некоторому химическому элементу, а число нейтронов — изотопу этого элемента. • • • • • • • • 1 микрометр - 10-6 м 1 нанометр - 10-9 м 1 ангстрем (1 Å) - 10-10 м. 1 пикометр - 10-12 м 1 фемтометр - 10-15 м 1 ангстрем – 100 пикометров 1 нанометр - 10 ангстрем самый маленький атом — это атом гелия, имеющий радиус 32 пм, а самый большой — атом цезия (225 пм). Эти размеры в тысячи раз меньше длины волны видимого света (400—700 нм) Атом Галия • Фридрих Хунд, Роберт Сандерсон Малликен и Джон Эдвард Леннард-Джонс в 1929 г. начали разработку метода молекулярных орбиталей. В основу ММО заложено представление о полной потере индивидуальности атомов, соединившихся в молекулу. Молекула, таким образом, состоит не из атомов, а представляет собой новую систему, образованную несколькими атомными ядрами и движущимися в их поле электронами. Постулаты заложили основу того подхода к описанию явлений микромира, придерживаясь которого последователи и ученики Н. Бора, прежде всего, самый гениальный из них Вернер Гейзенберг, пришли к созданию во второй половине 1925 года формализма матричной механики, который сегодня более привычно называется энергетическим или матричным представлением квантовой механики. Данный подход связан с идеей рассмотрения микрочастиц, по сути дела, как кoрпускул и описания процессов взаимодействия между ними с использованием только тех понятий, для которых можно указать процедуру их экспериментального измерения. При этом переход микросистемы из начального состояния в конечное происходит посредством некоего загадочного квантового скачка, а вопросы типа "Каково состояние электрона в то время, когда он после акта излучения переходит в атоме с одной боровской орбиты на другую?" объявлялись не имеющими физического смысла, поскольку состояние электрона, без его существенного изменения, в момент перехода не может быть измерено ни одним физическим прибором. Первая работа Гейзенберга "О квантовотеоретическом истолковании кинематических и механических соотношений" [1] поступила в редакцию одного из ведущих в то время научных журналов "Zeitschrift fr Physik" 29 июля 1925 года. Этот день принято считать днем рождения современной квантовой механики. Столкнувшись с тем, что при переходе от классической точки зрения к квантовой нужно разложить все физические величины и свести их к набору отдельных элементов, соответствующих различным возможным переходам квантового атома, он пришел к тому, чтобы каждую физическую характеристику квантовой системы представлять таблицей чисел (матрицей). При этом он сознательно руководствовался целью построить феноменологическую концепцию, чтобы исключить из нее все, что невозможно наблюдать непосредственно. В этом случае нет никакой необходимости вводить в теорию положение, скорость или траекторию электронов в атоме, поскольку мы не можем ни измерять, ни наблюдать эти характеристики. В расчеты следует вводить лишь те величины, которые связаны с реально наблюдаемыми стационарными состояниями, переходами между ними и сопровождающими их излучениями. В матрицах элементы были расположены в строки и столбцы, причем каждый из них имел два индекса, один из которых соответствовал номеру столбца, а другой - номеру строки. Диагональные элементы (т.е. элементы, индексы которых совпадают) описывают стационарное состояние, а недиагональные (элементы с разными индексами) - описывают переходы из одного стационарного состояния в другое. Величина же этих элементов связывается с величинами, характеризующими излучение при данных переходах, полученными с помощью принципа соответствия. Именно таким способом Гейзенберг строил матричную теорию, все величины которой должны описывать лишь наблюдаемые явления. И хотя наличие в аппарате его теории матриц, изображающих координаты и импульсы электронов в атомах, оставляет сомнение в полном исключении ненаблюдаемых величин, Гейзенберту удалось создать новую квантовую концепцию, составившую новую ступень в развитии квантовой теории, суть которой состоит в замене физических величин, имеющих место в атомной теории, матрицам - таблицам чисел. Любопытно, что Гейзенберг, получивший фундаментальное университетское образование в Мюнхене у самого Арнольда Зоммерфельда (Помните, "нет Бога кроме Бора и Зоммерфельд пророк его"?), не знал, что такое матрица, и самостоятельно выдумал матричное исчисление, исходя из физических требований, которые предъявляются к процессу измерения состояния микросистемы. Говорят, что когда об этом узнал Вольфганг Паули, то воскликнул: "Господи, какой ГЕНИАЛЬНЫЙ невежа, этот Гейзенберг!" Однако, вопреки впечатляющим результатам как при объяснении явлений микромира, так и при разработке математического аппарата, матричная механика встречалась в штыки многими физиками того времени. Не последнюю роль в холодном приеме новой механики, видимо, сыграло и неприязненное отношение одного из величайших немецких физиков-экспериментаторов Вильгельма Вина лично к Вернеру Гейзенбергу. Дело в том, что за несколько лет до описываемых событий Гейзенберг позорно провалился на экзамене у Вина, показав свое полное незнание основных экспериментальных методов физики того времени. Только личная просьба Зоммерфельда спасла Гейзенберга от реальной возможности остаться без университетского диплома. С тех пор и до конца своей жизни Вин считал Гейзенберга молодым выскочкойнеучем. Нильс Бор соединил в своей модели классические и квантовые представления о движении электрона. Однако искусственность такого соединения была очевидна с самого начала. Развитие квантовой теории привело к изменению классических представлений о структуре материи, движении, причинности, пространстве, времени и т.д., что способствовало коренному преобразованию картины мира. В 20-е годы прошлого века на смену модели Бора пришла волновая модель электронной оболочки атома, которую предложил австрийский физик Э. Шредингер. К этому времени было экспериментально установлено, что электрон имеет свойства не только частицы, но и волны. Например, видимый нашими глазами свет представляет собой электромагнитные волны. Ряд свойств таких волн есть и у электрона. Шредингер применил к электрону-волне математические уравнения, описывающие движение волны в трехмерном пространстве.