Лекция 2. Строение атомов - Томский политехнический
advertisement

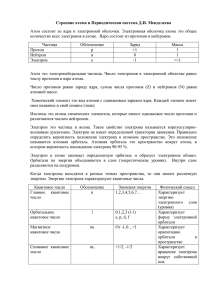
Строение атома Юрмазова Татьяна Александровна Томский политехнический университет План: 1. 2. 3. 4. 5. 6. 7. 8. История учений о строении атома Принцип неопределенности Гейзенберга Квантовые числа Заполнение атомных орбиталей электронами, электронные формулы. Электронографические формулы. Проскок электронов Периодический закон Менделеева Периодичность изменения свойств Долгое время в науке господствовало мнение, что атомы неделимы, т.е. не содержат более простых составных частей. Однако, в конце 19 века установлено ряд фактов о сложном строении атомов. Открытие электрона Дж. Томсоном (1897г. ) Электрон – элементарная частица, обладающая наименьшим существующим в природе отрицательным электрическим зарядом – 1,610-19 Кулон. Масса электрона равна 9,1 10-28 г, т.е. почти в 2000 раз меньше массы атома водорода. Модель Томсона (1897 г.) Атом состоит из положительного заряда, равномерно распределенного по всему объему атома, и электронов и колеблющихся внутри этого заряда. Ядерная модель строения атома (Резерфорд, 1911 г.) Атом состоит из положительного заряженного ядра, в котором сосредоточена преобладающая часть массы атома, и вращающихся вокруг него электронов. Следствие из опытов Резерфорда Заряд ядра численно равен порядковому номеру элемента в периодической системе. Заряд ядра определяется числом находящихся в нем протонов, сумма числа протонов Z и нейтронов N дает массовое число – А т.е. A = Z + N Разновидности элементов, атомы которых имеют одинаковый заряд ядра, но разные массовые числа, называют изотопами. Изотопы отличаются числом нейтронов в ядрах их атомов Са4020 – Са4220 – 20 протонов, 20 нейтронов, 20 протонов, 22 нейтронов. Противоречия теории Резерфорда 1. Теория Резерфорда не могла объяснить устойчивости атома. При вращении электрон испускает электромагнитную энергию в виде световых волн, непрерывно излучая электромагнитную энергию и, двигаясь по спирали, т.е. будет приближаться к ядру. Исчерпав свою энергию, он должен будет упасть на ядро, и атом прекратит свое существование. Это противоречит реальным свойствам атома, который представляет собой устойчивое образование. Противоречия теории Резерфорда 2. модель Резерфорда не смогла объяснить наличие линейчатых спектров у атомов. В 1900 г. Планк показал, что способность нагретого тела к лучеиспусканию можно количественно описать только предположив, что лучистая энергия испускается и поглощается телами не непрерывно, а дискретно, т.е. отдельными порциями – квантами. При этом энергия связана с частотой излучения ν. E = h·ν E – энергия кванта, Дж h – постоянная Планка h=6,610 -34Джс. ν – частота, с–1 Постулаты теории Бора (1913 г) 1. Электрон - может вращаться вокруг ядра не по любым, а только по некоторым определенным круговым орбитам. Эти орбиты получили название стационарные. 2. Двигаясь по стационарной орбите электрон не излучает электромагнитной энергии. 3. Излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую. При этом испускается или поглощается квант электромагнитного излучения, энергия которого равна разности энергии атома в конечном и Теория Луи де Бройля (1924г) Микрочастицы обладают не только корпускулярными, но и волновыми свойствами, т. е. обладают двойственной природой Уравнение Луи де Бройля Е=h v E=mc2 v = c/ = h/mv – уравнение де Бройля: частице с малой массой m, движущейся со скоростью v , соответствует волна с длиной , h -постоянная Планка. Принцип неопределенности Гейзенберга (1927 г.) Невозможно одновременно с достаточной точностью определить скорость и координаты частиц. Согласно этому принципу мы можем говорить только о вероятности пребывания в той или иной точке пространства. Область наибольшей вероятности нахождения электрона называется орбиталью (волновое облако). Уравнение Шредингера Исходя из представлений о наличии у электрона волновых свойств, Шредингер в 1925 г. предположил, что состояние электрона в атоме должно описываться следующим уравнением: 2 2 2 h ψ ψ ψ 2 2 2 2 Uψ Eψ 8π m x y z 2 где: ψ – волновая функция, U – потенциальная энергия, h – постоянная Планка, m – масса электрона, x, y, z – координаты E – полная энергия Квантовые числа Четыре квантовых числа описывают состояние электрона в атоме и характеризуют энергию электрона, его спин, форму электронного облака и его ориентацию в пространстве. При переходе атома из одного состояния в другое происходит перестройка электронного облака, т.е. изменяются значения квантовых чисел, что сопровождается поглощением или испусканием атомом квантов энергии 1. Главное квантовое число – n определяет энергию электрона на данном энергетическом уровне, номер уровня и размеры электронных облаков. Энергия электрона главным образом зависит от расстояния электрона от ядра – чем ближе находится электрон к ядру, тем больше его энергия взаимодействия с ядром. 1. Главное квантовое число – n Главное квантовое число имеет значения ряда целых чисел от 1 до ∞. При значении n = 1 электрон находится на первом энергетическом уровне. Электрон, находящийся на более удаленном энергетическом уровне, обладает максимальной энергией. Поэтому при переходе электрона с более удаленного энергетического уровня на более близкий 1. Главное квантовое число – n Энергетические уровни обозначаются: 1 2 3 4 5 K L M N Q 2. Орбитальное квантовое число – L определяет форму атомной орбитали (электронного облака), которое имеет значения от 0, 1, 2… до (n – 1). Каждому значению L, соответствует орбиталь определенной формы 2. Орбитальное квантовое число – L Орбитальное квантовое число принято обозначать буквенными символами: L= 0 1 2 s p d 3 4 5 f g b 2. Орбитальное квантовое число – L На одном энергетическом уровне начиная со 2-го разные по форме орбитали, электрон находится на разных энергетических подуровнях. n (уровень) L (подуровень) Обозначение подуровней 1 2 3 4 0 0, 1 0, 1, 2 0, 1, 2, 3 1s 2s, 2p 3s, 3p, 3d 4s, 4p, 4d, 4f Как видно первый энергетический уровень не расщепляется на подуровни, число подуровней равно (2L+1). для первого уровня (n=1) возможна 1 форма орбитали (s), для второго уровня (n=2) – две формы орбитали (s, p) для третьего уровня (n=3) – три формы орбитали (s, p, d) и т.д. Формы атомных орбиталей Согласно квантово – механическим расчетам уравнения Шредингера: s – орбиталь имеет форму шара, p – орбиталь форму гантели, d и f орбитали более сложные. При обозначении электрона главное квантовое число пишут перед символом орбитального квантового числа. Например: 4s- означает электрон у которого n=4; l=0,облако имеет форму шара, 2р – означает электрон у которого n=2; l=1облако имеет форму гантели. 3. Магнитное квантовое число – m отвечает за пространственную ориентацию атомных орбиталей, оно зависит от орбитального квантового числа и принимает значения в интервале от + l до – l через нуль. 3. Магнитное квантовое число – m Для каждого значения l разрешено (2l + 1) значений m. Все орбитали одного подуровня l обладают одинаковой энергией, но по разному ориентированы относительно друг друга Примеры Допустим, l =1, это – p подуровень m=+1,т.е. m=+1,0,-1. Следовательно на Р подуровне находится 3 орбитали. Допустим, l =2, d-подуровень m=+2,т.е. m=+2, +1,0,-1, -2. Следовательно на Р подуровне находится 5 орбиталей. 4. Спиновое число S или mS характеризует собственный магнитный момент электрона в атоме и принимает значения + ½ или – ½. 4. Спиновое число S или mS Поскольку спин – величина векторная, его условно обозначают стрелкой (↑ или ↓). Электроны имеющие одинаковое направление спина называются параллельными, при противоположном антипараллельными. Заполнение атомных орбиталей электронами, электронные формулы Заполнение электронами атомных орбиталей и энергетических уровней происходит согласно: правила Клечковского, принципа наименьшей энергии, принципа Паули, правила Гунда. Правила Клечковского Определяют последовательность заполнения орбиталей: Заполнение энергетических уровней происходит в порядке возрастания суммы чисел (n+l) При равных значениях (n+l) в первую очередь заполняется состояние с меньшим значением главного квантового числа. Принцип Паули в атоме не может быть двух электронов у которых были бы одинаковыми все четыре квантовых числа. Правило Гунда На данном подуровне электроны стремятся занять энергетические состояния таким образом, чтобы суммарный спин был максимальным. Следствие из принципа Паули максимально возможное число электронов на каждом энергетическом уровне равно удвоенному значению квадрата главного квантового числа: N = 2n2 ; число подуровней: 2l +1; число электронов на подуровне равно 2(2l +1) № уровня 1 2 3 число ē 8 18 32 2 4 Электронную формулу представляют с помощью двух квантовых чисел. В электронной формуле главное квантовое число обозначается цифрой, орбитальное буквой, а количество электронов записывается, как показатель степени к орбитальному квантовому числу. Чтобы записать электронную формулу элемента, находят в периодической системе порядковый номер элемента, который соответствует количеству электронов. Номер периода говорит о максимальном значении главного квантового числа. Пример Написать электронную формулу марганца. №25, период 4 2 1s 2 2s 6 2p 2 3s 6 3p 2 4s 5 3d В электронографических формулах каждая орбиталь изображается в виде квадрата и называется квантовой ячейкой, а электроны обозначаются стрелками Пример Рассмотрим углерод - №6 С Электронная формула - 1s2 2s2 2p2 Электронографическая формула 2p 2s 1s Каждый электрон характеризуется набором квантовых чисел. Охарактеризуем обведенный электрон: n=2 l=1 m=0 s=½ Проскок электронов Следует отметить, что при составлении электронных формул элементов есть некоторые отклонения от правила Клечковского. Например, элемент № 24 Cr 1s22s22p63s23p64s23d4 - это ожидаемая электронная конфигурация, а действительно – 4s13d5. В атоме есть состояние электрона с повышенной стабильностью р6 d10 f14 и p3 d5 f7, более устойчивое состояние - это, когда энергия связи электрона с ядром наибольшая, такие отклонения от правила Клечковского называются проскоком электронов. Примерно у 10 элементов периодической системы наблюдается проскок Периодический закон Д.И. Менделеева Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атома или порядкового номера элемента. Выражением периодического закона служит таблица, наглядно отражающая эти закономерности и получившая название периодической системы элементов Менделеева. Период Периодом называется горизонтальная совокупность химических элементов в атомах которых происходит заполнение электронами одного и того же валентного слоя, имеется 7 периодов Группы Группы – вертикальные столбики химически элементов, имеющих одинаковое число валентных электронов, номеру группы соответствует максимальная валентность. Группы делятся на подгруппы. Подгруппы Главные подгруппы начинаются со 2 периода, в них находятся s и p -элементы. Побочные подгруппы включают d-элементы и начинаются с 4 периода. Электронные аналоги Полные электронные аналоги - элементы одной и той же подгруппы Неполные электронные аналоги – элементы одной группы главной и побочной подгрупп. s-элементы: Элементы, имеющие в качестве валентных электронов только s – электроны например: Li (литий) – 2s1, Ca (кальций) – 4s2, p – элементы: элементы, имеющие в качестве валентных электронов s и p электроны например: N (азот) – 2s2 2p3; S (сера) – 3s2 3p4. d-элементы: элементы, имеющие в качестве валентных электронов s и d электроны например: Sc (скандий) – 4s2 3d1. f-элементы: элементы, имеющие в качестве валентных электронов s и f электроны например: La (лантан) – 6s2 4f1. S - элементы: элементы, имеющие в качестве валентных электронов только s – электроны например: Li (литий) – 2s1 d - элементы: элементы, имеющие в качестве валентных электронов s и d электроны например: 2 1 Sc (скандий) – 4s 3d . f - элементы элементы, имеющие в качестве валентных электронов s и f электроны например: 2 1 La (лантан) – 6s 4f . От неодинакового строения электронной оболочки атомов зависят такие свойства, как размер атомов, энергия ионизации, электроотрицательность, сродство к электрону. Периодичность изменения свойств Атомный Энергия (ионный) радиус (R) ионизации (I) Сродство к электрону (F) Электроотрицательность Атомный (ионный) радиус (R) Квантово-механический характер движения электрона в атоме не позволяет точно определить радиус атомов (электрон может быть обнаружен на любом расстоянии от ядра с определенной вероятностью), поэтому используют так называемые эффективные радиусы атомов и ионов. Кроме того, используют так называемые орбитальные радиусы атомов, определяемые как расстояние от ядра до последнего максимума электронной плотности. Радиусы одноатомных катионов меньше, а анионов больше, чем радиус соответствующего нейтрального атома. R(F)= 0,64 A°, R(F-)=1,36 A° R(Na)=1,54 A°, R(Na+)=0,95 A° 1A°=10–10 метра а) по группе вниз эффективный радиус атома (R) увеличивается - т.к. увеличивается число энергетических уровней, увеличиваются металлические свойства. б) по периоду эффективный радиус атома (R) уменьшается, т.к. количество уровней одинаково, а количество электронов увеличивается- происходит сжатие электронной оболочки, металлические свойства ослабевают. Be 2s2 O N B C 2 4 2s22p1 2s22p2 2s22p3 2s 2p Li - 2s1 Na- 3s1 K - 4s1 Rb - 5s1 Cs - 6s1 Fr - 7s1 Radii Радиус decrease уменьшается i nр cа rс e aт sе eт Зависимость орбитального радиуса атомов от атомного номера элементов R нм K Na Li H Ne He Kr Ar Зависимость эффективного радиуса атомов от атомного номера элементов R нм K Na Kr Li Ar Ne He H Энергия ионизации (I) это количество энергии, необходимое для отрыва электрона от атома - Энергия ионизации является количественной характеристикой восстановительной способности атомов. а) Энергия ионизации (I) по группе вниз – уменьшается в) Энергия ионизации (I) по периоду – увеличивается Зависимость энергии ионизации атома от порядкового номера элемента J, эВ/ атом He Ne Ar Kr H Li Na K Сродство к электрону (F) это энергия, которая выделяется при присоединении электрона к нейтральному атому (кДж/моль или эВ) или способность атома одного элемента оттягивать на себя электроны от атомов другого элемента А + е = А– + F а) по группе вниз сродство к электрону уменьшается б) по периоду сродство к электрону увеличивается Сродство к электрону характеризует окислительную способность атома Электроотрицательность Согласно Полингу: Электроотрицательность (Э.О.) - это способность атома в молекуле притягивать к себе электроны. Э.О. равна полусумме энергии ионизации и сродства к электрону: Э.О.=1/2 (F+I) Фтор самый электроотрицате льный элемент. Электроотрицательность по периоду возрастает Электроотрицательность сверху вниз по группе падает Ионы и атомы, имеющие одинаковое электронное строение называются изоэлектронными: + – 2 2 6 Na , F , Ne - 1s 2s 2p