5_Вступление в обмен веществ
реклама

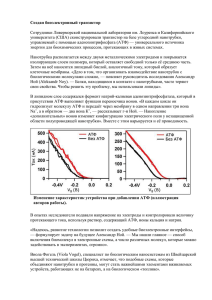
Вступление в обмен веществ. Специфические и общие пути превращения углеводов, липидов и белков (окислительное декарбоксилирование ПВК, цикл трикарбоновых кислот). • Метаболизм – химические реакции, которые проходят в организме • Метаболиты – маленькие промежуточные молекулы, которые образуются в процессе деградации и синтеза полимеров Последовательность реакций, которые имеют цель (например, расщепление глюкозы, синтез жирных кислот) называется метаболическимм путем Метаболические пути могут быть: (a) Линейными (b) Циклическими (c) Спиральными (синтез жирных кислот) Метаболизм разделяется на – катаболизм и анаболизм Катаболические реакции – деградация больших молекул с образованиемм меньших и энергии Анаболические реакции – синтез макромолекул для жизнедеятельности клеток, роста и репродукции Катаболизм характеризируется реакциями окисления и освобождения энергии, которая трансформируется в АТФ Анаболизм характеризируется реакциями восстановления и утилизацией энергии, аккумулированной в АТФ Регуляция метаболических путей Уровни регуляции метаболизма 1.Нервная система 2.Эндокринная система 3.Взаимодействие между органами 4.Клеточный (мембранный) уровень 5.Молекулярный уровень Стадии метаболизма Катаболизм Стадия I (специфическая). Деградация макромолекул (белков, углеводов, липидов) до мономеров Стадия II (специфическая). Аминокислоты, жирные кислоты и глюкоза окисляются к общему метаболиту – ацетил коэнзиму А Стадия III (неспецифическая). Ацетл СoA окисляется в цикле лимонной кислоты до CO2 и воды ОКИСЛИТЕЛЬНОЕ ДЕКАРБОКСИЛИРОВАНИЕ ПИРУВАТА Глюкоза Гликолиз Аминокислоты Пируват Ацетил CoA Глицерол Транспорт пирувата в митохондрию Превращение пирувата в ацетил СоА • Пируват дегидрогеназный комплекс - полиферментный комплкс, который состоит из 3 ферментов, 5 коферментов Пируватдегидрогеназный комплекс - молекулярная масса от 4 до 10 млн дальтон Электронная микрофотография пируватдегидрогеназного комплекса E. coli. Ферменты: E1 = пируват дегидрогеназа E2 = дигидролипоилацет илт рансфераза E3 = дигидролипоилдегидрогеназа Коферменты: ТПФ (т иамин пирофосфат ), липоамид, HS-КoA, ФАД, НАД+. ТПФ является производным витамина B1 (тиамин); НАД –B5 (никотинамид); ФАД –B2 (рибофлавин), HS-CoA –B3 (пантотеновая кислота), липоамид – липоевая кислота Общая реакция пируватдегидрогеназного комплекса Цикл трикарбоновых кислот Названия: Цикл трикарбоновых кислот Цикл лимонной кислоты Цикл Кребса У эукариот все реакции цикла Кребса проходят в матриксе митохондрий Ганс Адольф Кребс Биохимик; родился в Германии. Работал в Британии. Его открытие в 1937 р, цикл Кребса, было критическим для понимания клеточного метаболизма. Нобелевская премия в 1953 г. Общие представления о цикле Кребса Цикл лимонной кислоты. Ферменты: 1 — цитратсинтаза; 2 — аконитаза; 3 — изоцитратдегидрогеназа; 4 — а-кетоглутаратдегидрогеназный комплекс; 5 — сукцинаттиокиназа; 6 — сукцинатдегидрогеназа; 7 — фумаратгидратаза; 8 — малатдегидрогеназа. Функции цикла трикарбоновых кислот • Интеграция метаболизму. Цикл является амфиболичным (катаболичным и анаболичным одновременно). • Образование энергии в форме ГТФ (ATФ). • Образование восстановительных эквивалентов в форме НАДН и ФАДH2 Регуляция цикла трикарбоновых кислот - NADH, ATP, succinyl CoA, citrate Цикл Кребса как источник биосинтетических предшественников Glucose Phosphoenolpyruvate The citric acid cycle provides intermediates for biosyntheses Окислитель ное фосфорилирование создает условия для АТФ -универсальная формой энергии в живых организмах БИОЛОГИЧЕСКОЕ НИЕ Хемиосмотическая теория • Предложена Питером Митчелом в 1960 (Нобелевская премия, 1978) • Хемиосмотическая теория: т ранспорт элект ронов и синт ез АТФ объеденены прот онным градиент ом через внут реннюю мембрану мит охондрий + + + - - - + + + - 1. Необходима интактная митохондриальная мембрана 2. Транспорт электронов через ЭТЦ генерирует прот онный градиент 3. AТФ синт аза катализирует фосфорилирование АДФ в реакции, которая обеспечивается прохождение Н+ через внутреннюю мембрану в матрикс АТФ синтаза Две субъединицы, Fo и F1 F1 содержит каталитические субъединицы, г е АДФ и Pи связываются. F0 пронизывает мембрану и служит как протонный канал. Энергия, которая освобождаетсяться при “падении” протонов используется для синтеза АТФ. Активный транспорт ATФ, AДФ и Pн через внутреннюю митохондриальную мембрану • АТФ должен транспортироваться в цитозоль, а АДФ и Pн - в матрикс • AДФ/ATФ переносчик меняет митохондриальное ATФ на цитозольное АДФ • Фосфат (H2PO4-) транспортируется в матрикс за механизмом симпорта з H+. • Переносчик фосфата снижает pH. РЕГУЛЯЦИЯ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ Сопряжение тканевого дихания с окислительным фосфорилированием Транспорт электронов тесно связан с фосфорилированием. АТФ не может быть синтезирован путем окислительного фосфорилирования если нет энергии освобожденной при электронном транспорте. Электроны не проходят через электрон-транспортную цепь если АДФ не фосфорилируется до АТФ. Основные регуляторы: НАДН, O2, AДФ Внутримитохондриальное соотношение АТФ/АДФ является контрольным механизмом Высокое соотношение ингибирует так как АТФ аллостерически связывается с комлексом IV Дыхательный контроль Регуляция скорости окислительного фосфорилирования с помощью уровня АДФ называется дыхательным конт ролем Разобщение тканевого дыхания и окислительного фосфорилирования Внутрення митохондриальная мембрана содержит белокразобщения. Белок-разобщения образует канал для перехода протонов из цитозоля в матрикс. Разобщители • Разобщителями являются жирорастворимые слабые кислоты • Разобщители снижают протонный градиент транспортируя протоны через мембрану 2,4-Динитрофенол – эффективный разобщитель Выход АТФ 10 протонов выкачиваются из матрикса во время транспорта двух электронов от НАДН к O2 (комплекс I, III и IV). 3 4 4 2 Выход АТФ 3 4 4 2 Перенос 3H+ необходим для синтеза одной молекулы АТФ АТФ-синтазой 1 H+ необходим для транспорта Pн. 4 H+ используется для каждой синтезированной АTФ Для НАДН: 10 H+/ 4H+ = 2.5 АТФ Для ФАДН2: 6 H+/ 4 H+ = 1.5 ATФ