Презентация к курсу Биология синтез белка
реклама

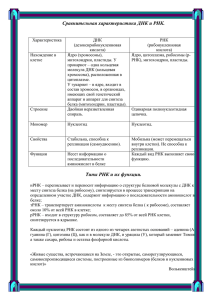
Презентация к курсу Биология для студентов 1го курса геолого-географического факультета Тема: Синтез белка Составитель: доц. каф. ботаники Гарнизоненко Т.С. Функции белка Белки – нерегулярные биополимеры, мономерами или субъединицами которых являются аминокислоты. 1. Структурная и строительная (коллаген, склеротин, белки оболочки вирусов, мембранные белки). 2. Каталитическая или ферментативная (каталаза, дегидрогеназа, полимераза), 3. Регуляция физиологических процессов (инсулин, гормон роста, адренокортикотропный гормон), 4. Защитная (иммуноглобулины, интерферон, фибриноген), 5. Двигательная (сократительные белки – актин и миозин, тубулин), 6. Транспортная (гемоглобин, белки-переносчики), 7. Токсическая (змеиный яд, дифтерийный токсин) 8. Запасающая (казеин-белок молока, яичный альбумин, белки семян бобовых) 9. Рецепторная (родопсин, холинрецептор), 10. Регуляторная ( белки-репрессоры, гистоны) 11. Энергеттическая Классификации белка 1. По форме молекулы 2. По молекулярной массе: - фибриллярные, - низкомолекулярные, - глобулярные. - высокомолекулярные. 3. По химическому составу: - простые (яичный альбумин) - сложные (фосфо-, липо-, нуклеопротеиды). 4. По выполняемым функциям: 5. По локализации: - транспортные, - ядерные, - регуляторные, - цитоплазматические, - защитные и т.д. - лизосомальные. 6. По особенностям синтеза: - конститутивные (скорость постоянна), - индуцибельные (скорость меняется под воздействием внешних факторов). 7. По продолжительности жизни: - быстро обновляющиеся ( время жизни менее 1 часа – протеазы, белок дрожжей вызывающий образование прионов), - медленно обновляющиеся (время жизни от нескольких недель до нескольких месяцев кристаллин хрусталика глаз) Органоиды, принимающие участие в синтезе белка !. Ядро 2. Цитоплазма 3. Эндоплазматическая сеть 4. Рибосомы 5. Митохондрии Компоненты синтеза белка 1. Аминокислоты 2. Нуклеиновые кислоты 3.АминоацилтРНК синтетаза 4. АТФ, ГТФ 5. Кодаза 6. Рибосомы (полисомы) 7. Белковые факторы инициации, элонгации и терминации 8. Ионы магния Аминокислоты Классификации аминокислот: 1. По строению: Триптофан - моноаминокарбоновые (глицин, аланин), NH2 —CH2 —COOH - диаминомонокарбоновые (лизин), - моноаминодикарбоновые (аспарагиновая) Глицин - с пяти- и шестичленными циклами (триптофан), - с иминогруппой (пролин). 2. Оптическая изомерия - правовращающие (D), Пролин - левовращиющие (L). 3. Синтез в клетке - заменимые, - незаменимые: валин, изолейцин, лейцин, D -аланин L –аланин (в живых системах) лизин, метионин,треонин, триптофан, фенилаланин, для детей также: аргинин и Гистидин. 4. Состав: - простые (яичный альбумин) и сложные (фосфо-, липо-, нуклеопротеиды) Образование пептидной связи и структура белков Схема образования пептидной связи Уровни структурной организации белковой молекулы: - первичная структура (пептидная ковалентная прочная связь, линейная структура) - вторичная структура (водородные связи, непрочныые, спираль --стр, складчатая - -стр. фибриллярные), - третичная структура (гидрофобные, ионные, водородные, S-S связи, , глобулярные), - четвертичная структура (водородные, ионные, гидрофобные нековалентные, непрочные взаимодействия) Уровни организации белковой молекулы Белки вторичной структуры: коллаген (А), миозин, фиброин (белок паутины). Белки третичной структуры: химотрипсин, иммуноглобулины (Б). Белки четвертичной структуры: гемоглобин (В) А Б С - субъединицы окрашены в разные цвета Пептиды Пептиды – низкомолекулярные белки, содержащие не более 30 аминокислот. Все пептиды имеют свою собственную узкую специализацию. Для каждой ткани подходит только свой пептид: для легких – легочный, для печени – печеночный, для мозга – мозговой. В то же время пептиды одного типа одинаковы для всех млекопитающих. Природные опиоидные пептиды выделены впервые в 1975 г. из мозга млекопитающих. Это были так называемые энкефалины — (молекулярная масса 556 - 574), представляющие собой пептиды, различающиеся лишь концевым Состатком. Из экстрактов тканей гипофиза и гипоталамуса млекопитающих выделены и другие опиоидные пептиды, получившие групповое название эндорфины, которые в N-концевой области молекулы содержат обычно остаток энкефалина. Среди эндорфинов наиболее активен b-эндорфин, состоящий из 31 аминокислотного остатка Энкефалины и эндорфины обладают обезболивающим действием влияют на эмоциональное состояние, вызывая эйфорию (поэтому их называют «гормонами радости» или «природными наркотиками»), влияют на память и способность обучаться. :нормализуют артериальное давление, нормализуют частоту дыхания, положительно влияют на деятельность почек и пищеварительной системы. ускоряют заживление поврежденных тканей, образование костной мозоли при переломах, повышают сопротивляемость сепсису. Белки-прионы Прионный белок, обладающий аномальной трёхмерной структурой, способен прямо катализировать структурное превращение гомологичного ему нормального клеточного белка в себе подобный (прионный), присоединяясь к белку-мишени и изменяя его конформацию. Как правило, прионное состояние белка характеризуется переходом -спиралей белка в - слои. Прионы — единственные инфекционные агенты, размножение которых происходит без участия нуклеиновых кислот. Во второй половине ХХ века врачи столкнулись с необычным заболеванием человека — постепенно прогрессирующим разрушением головного мозга происходящим в результате гибели нервных клеток. Это заболевание получило название губчатой энцефалопатии. В 1997 г. американскому врачу Стенли Прузине ру была присуждена Нобелевская премия за изучение прионов. До конца механизм спонтанного возникновения прионных ифекций не ясен. Считается (но ещё не полностью доказано), что прионы образуются в результате ошибок в биосинтезе белков.Мутации генов, кодирующих прионный белок (PrP), ошибки трансляции, процессы протеолиза— считаются главными кандидатами на механизм возникновения прионов. Болезнь Крейцфельда-Якоба-Шейнкера, фатальная семейная бессонница, болезнь Куру, синдром Герстманна-Штрауслера (снижение глотания и фониации, деменция) – основные прионные болезни человека. А Б Б-прионы коровьего бешенства нормальный-А и патогенный (Б) Нуклеиновые кислоты (НК) НК- биополимеры, осуществляющие хранение и передачу генетической информации у всех живых организмов. Присутствуют в ядре, цитоплазме, митохондриях, хлоропластах. Мономерами НК являются нуклеотиды в состав которых входят азотистые основания – аденин, гуанин, цитозин, тимин и урацил, пентозы (рибоза или дезоксирибоза) и остаток фосфорной кислоты. Два нуклеотида с помощью диэфирной связи между фосфорным остатком Одного и пентозой другого образуют динуклеотид. Аналогичным способом образуются полинуклеотидные цепи любой длины. Нуклеиновые кислоты представлены двумя группами: дезоксирибонуклеиновые кислоты (ДНК) и различные по строению и функциям рибонуклеиновые кислоты (РНК) Дезоксирибонуклеиновая кислота Функции: - хранение ти передача генной информации, -участие в синтезе белка Химический состав: - азотистые основания аденин (А), гуанин (Г), цитозин (Ц) и тимин (Т), число аденина всегда равно числу тимина, а гуанина-числу цитозина (правило Чаргаффа), - пентоза – дезоксирибоза, - остаток фосфорной кислоты. Строение: Двойная спираль, цепи которой удерживаются благодаря комплементарным связям между Схема строения ДНК основаниями (2 связи в паре А-Т и 3 связи в паре Г-Ц). Существуют 2 варианта -спираль закрученная вправо (наиболее часто) и левоспиральная -форма. В хромосоме небольшие участки спирали закручены вокруг особых ядерных белков – гистонов, образуя нуклеосомы, которые разделены участками спейсерной или линкерной части ДНК. Участки цепи несущие информацию. называются экзонами, не несущие – интронами. Свойства ДНК 1.Стабильность. Она обеспечивается водородными, гликозидными и фосфодиэфирными связями, а также механизмом репарации спонтанных и индуцированных повреждений; 2.Способность к репликации. Благодаря этому механизму в соматических клетках сохраняется диплоидное число хромосом. Схематично псе перечисленные особенности ДНК как генетической молекулы изображены на рисунке. 3.Наличие генетического кода. Последовательность оснований в ДНК с помощью процессов транскрипции и трансляции преобразуется в последовательность аминокислот в полипептидной цепи; 4.Способность к генетической рекомбинации. Благодаря этому механизму образуются новые сочетания сцепленных генов. 5.Полярность. На 5’-конце полинуклеотидной цепи свободен остаток фосфорной кислоты, на 3’ -конце – сахар. 6.Антипараллельность. Против 5’-конца одной цепи расположен 3’ -конец другой. Информация в ДНК записана с помощью генетического кода. Генетический код Генетический код - свойственный всем живым организмам способ кодирования аминокислотной последовательности белков при помощи последовательности нуклеотидов. Запись производится на основе 4 азотистых оснований (АО), аминокислот – 20, поэтому зашифровать аминокислоту одним или двумя АО невозможно, и единственным способом кодировки является триплет или кодон, состоящий из 3-х нуклеотидов. Свойства генетического кода: - триплетность, - вырожденность, - однозначность, - неперекрываемость , - универсальность «Качание» третьей «буквы» кода позволяет тРНК считывать более одного кодона. Центральный круг – 1-я буква кодона, внутренний - 2-я, наружный – 3-я Рибонуклеиновая кислота Функции: - участие в синтезе белка: - а – переписывание и перенос генетической информации (и-РНК,м-РНК), - б – построение рибосомы (р-РНК), - в – транспорт аминокислот, адаптер (т-РНК), - г – участие в процессинге, редакция ДНК (мя – РНК) Химический состав: - азотистые основания: аденин (А), цитозин (Ц), гуанин (Г), урацил (У) -пентоза – рибоза, - остаток фосфорной кислоты. Строение: Одна правозакрученная спираль, цепь нуклеотидов обеспечивается связью рибозы и остатка фосфорной кислоты. Схема строения РНК Типы РНК (м-РНК и р-РНК) м-РНК (и-РНК) – матричная или информационная РНК на нее переписывается информация со смысловой цепи ДНК, она же доставляет эту информацию к рибосоме. Структура – линейная, число нуклеотидов – от нескольких сотен до нескольких тысяч. р-РНК – рибосомальная РНК, в комплексе с белками (50:50) образует рибосомы, структура нелинейная, число нуклеотидов – 3-5 тысяч. р-РНК обеспечивает первичное связывание рибосомы с мРНК т формирует активный центр рибосомы, где образуется пептидная связь. Уникальность р-РНК заключается в ее способности к репликации и катализу. Транспортная т-РНК Функции: - опознание аминокислоты (АК) - акцепторная (присоединение АК) -транспорт АК в составе комплекса т-РНКАК, - адаптерная (перевод с языка НК на язык АК), определение правильности подбора соответствующих АК. Строение: состоит из 75-95 нкулеотидов вторичная структура – 4 стебля и 3 петли – «клеверный лист» (А),третичная пространственная структура (Б), Форма – напоминает перевернутую латинскую букву L. В молекуле т-РНК различают акцепторный стебель, он имеет одинаковое строение у всех т-РНК - ССА антикодоновый участок и две дополнительные петли. Б А Семейство малых РНК Антисмысловая РНК (aRNA) – закрывают участок мРНК-мишени от транскрипции. МикроРНК (miRNA) – останавливают транскрипцию некоторых генов (22 нуклеотида). Малые ядерные РНК, мя-РНК (snRNA) – сплайсинг, поддержка целостности теломер. Малые ядрышковые РНК (snoRNA) –короткие с двумя неспаренными основаниями на концах – сплайсинг тРНК, мРНК, мяРНК. Короткие РНК (shRNA) – образуют шпильки, выключают экспрессию генов. Двухцепочечные РНК (siRNA) – участвуют в противовирусных ответах (21 нуклеотид). Пиви -РНК (piRNA ) – связываются с особым типом белка – piwi прекращают экспрессию при сперматогенезе (26-30 нуклеотидов). Мт-РНК (mtRNA) - необычный тип РНК, который действует в качестве тРНК и мРНК обнаружены во многих бактериях и пластидах. При остановке рибосомы на дефектных мРНК без стоп-кодонов, тмРНК присоединяет небольшой пептид, направляющий белок на деградацию. Гид(редактор) РНК (gRNA) – редактирует молекулы ДНК и всех типов РНК Транскрипция Синтез белка можно разделить на два этапа: 1-й – транскрипция и 2-й –трансляция. Транскрипция – переписывание генетической информации с ДНК на м(и)- РНК. Последовательность событий транскрипции: - нарушение связи ДНК с гистонами и расплетение двух цепей с образованием репликативной вилки или репликона (у прокариот раскручивается вся цепь ДНК, у эукариот только необходимый участок), - синтез м-РНК на смысловой цепи ДНК, состоит из инициации, элонгации и терминации; осуществляется ферментом РНК-полимеразой; для разрушения дублета м-РНК-ДНК необходим особый белок. Схема репликона Синтез м-РНК на смысловой цепи ДНК Структурные элементы рнк-полимеразы Транскрипция (процессинг и сплайсинг) - процессинг- созревание м-РНК, состоит из сплайсинга и маркирования. сплайсинг - удаление (вырезание некодирующих участков – интронов из молекулы пре-мРНК и сшивание кодирующих экзонов с помощью мя-РНК, маркирование – прикрепление к начальному участку м-РНК «шапочки -cap»кэпирование, метилирование первых 2-х рибоз, а к конечному участку – последовательности из нескольких 100-200 молекул адениловой кислоты -poly-A (полиаденилирование). Схема сплайсинга Схема кэпирования Трансляция Трансляция – второй этап синтеза: перевод последовательности уклеотидов в последовательность аминокислот, завершается образованием специализированной белковой молекулы. Он состоит из трех процессов: инициация, элонгация (самый длительный) и терминация Трансляция, подготовка в инициации Нативная структура тРНК Присоединение аминокислоты к тРНК Инициация и начало элонгации Р –центр в собранной рибосоме присоединяет инициирующий кодон с метионином (во всех белках), А-центр – первую «значимую» аминокислоту) - специфична для каждого белка. Элонгация Образование связи кодон-антикодон Перемещение рибосомы по цепи иРНК Трансляция, процесс терминации Посттрансляционная модификация белка После окончания синтеза белка в каналах ЭПС белки подвергаются посттрансляционным изменениям: 1. Присоединение различных химических групп, в т.ч. и гидрофобных для локализации в мембране. 2. Изменение линейной структуры белковой молекулы, возникновение дисульфидных связей. 3. Удаление N –концевого остатка метионина. 4. Присоединение других молекул белков и пептидов. Подобным изменениям подвергается как основная, так и боковые цепи Белковой молекулы. Регуляция синтеза белка Франсуа Жакоб (слева)и Жак-Люсьен Моно (справа) – создатели теории оперона – Нобелевские лауреаты (1965)