ПрезентацияСеменов сентябрь 2015
реклама

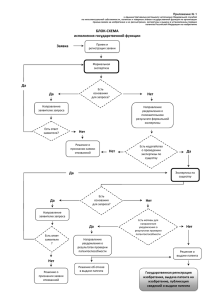
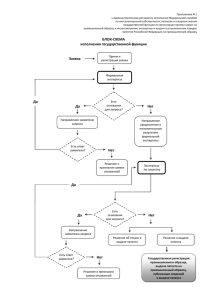
Правовая охрана изобретений в Российской Федерации Омск 30.09.2015 Зав. отделом фармацевтики ФИПС Роспатента Семенов В.И. Федеральная служба по интелектуальной собственности Картина дня 22 крупнейшие российские компании получили в 2014 году около 1 тыс. патентов. Компания «IBM» запатентовала 5 тыс. изобретений. Компания «Microsoft» - более 3 тыс. Компания «Siemens» - 873 тыс. Продажи наукоемкой продукции оцениваются ежегодно в 2 трлн. долларов, из которых 39% приходится на США, 30% на Японию, 16% на ФРГ и лишь 0,3% на Россию. В США ежегодно подается около 500 тыс. заявок на изобретения, в Японии около - 400 тыс., в Германии свыше - 60 тыс., в Южной Корее - 170 тыс. В России аналогичный показатель составляет лишь порядка 40 тыс. заявок, из которых 15 тыс. принадлежат иностранным компаниям и изобретателям. Поступление в Роспатент заявок на изобретения 50000 45000 40000 Кол-во заявок 35000 30000 РФ 25000 Иностранные 20000 Всего 15000 10000 5000 0 2002 2004 2006 2008 Годы 2010 2012 2014 Статистические данные за 2012г. Ведомства Количество поступивших заявок Количество завершенных заявок Количество экспертов Количество заявок, приходящих на 1 эксперта в месяц Количество решений о выдаче патента EPO 257 744 111 860 + 103 601 3987 2,3 + 2,2 65 687 (58,7%) USPTO 530 915 574 854 7935 6 246 464 (42,8%) JPO 342 796 708 417 1713 18,5 254 502 (35,9%) DPMA 61 311 29 306 720 3,4 11 324 (38,6%) РОСПАТЕНТ 44 211 42 054 513 6,8 32 428 (77,1%) Россия: Количество решений, вынесенных с первоначальной формулой – 18 322 (56,5%) Количество решений, вынесенных с измененной формулой – 13 791 (43,3%) Поступление заявок в отдел фармацевтики из Российской Федерации 4000 Заявки, поданные физическими лицами 3500 Кол-во заявок 3000 Заявки, поданные юридическими лицами 2500 2000 Заявки, поданные учебными заведениями 1500 1000 Общее количество заявок 500 0 2002 2004 2006 2008 Годы 2010 2012 2014 Количество заявок по тематикам МПК. А61К – лекарства и медикаменты 2002 2004 2006 2008 2010 2012 2014 Лечебная косметика А 61 К 8/00 – 8/99 11 67 144 189 150 145 144 Индивидуальные химические соединения Неорганические А 61 К 33/00-33/44, 31 92 151 130 122 92 33 Индивидуальные химические соединения Органические A61K 31/00- 31/80 201 663 869 951 838 769 690 Животное сырье А 61 К 35/12-35/76 61 189 238 217 159 168 104 Растительное сырье А 61 К 36/00 – 36/9068 13 147 215 253 179 166 118 Биотехнология (антигены и антитела) А 61 К 39/00 – 39/64 22 82 165 162 172 197 129 Нанопрепараты А 61 К + В 82 В 1/00 0 0 2 21 23 32 0 Всего заявок по рубрике А61К А61К – лекарства и медикаменты 905 1337 1770 1913 1805 1924 1743 Патентное право Статья 1225 гл.69 часть 4-ая ГК РФ 1. Результатами интеллектуальной деятельности и приравненными к ним средствами индивидуализации юридических лиц, товаров, работ, услуг и предприятий, которым предоставляется правовая охрана (интеллектуальной собственностью), являются: 1) произведения науки, литературы и искусства; 2) программы для электронных вычислительных машин (программы для ЭВМ); 3) базы данных; 4) исполнения; 5) фонограммы; 6) сообщение в эфир или по кабелю радио- или телепередач (вещание организаций эфирного или кабельного вещания); 7) изобретения; 8) полезные модели; 9) промышленные образцы; 10) селекционные достижения; 11) топологии интегральных микросхем; 12) секреты производства (ноу-хау); 13) фирменные наименования; 14) товарные знаки и знаки обслуживания; 15) наименования мест происхождения товаров; 16) коммерческие обозначения. 2. Интеллектуальная собственность охраняется законом. Статья 1226 часть 4-ая ГК РФ На результаты интеллектуальной деятельности признаются интеллектуальные права, которые включают исключительное право, являющееся имущественным правом, а в случаях, предусмотренных настоящим Кодексом, также личные неимущественные права и иные права (право следования, право доступа и другие). Статья 1345 пункт 1 часть 4-ая ГК РФ Интеллектуальные права на изобретения, полезные модели и промышленные образцы являются патентными правами. 1. Статья 1349 пункт 1 часть 4ая ГК РФ 1. Объектами патентных прав являются результаты интеллектуальной деятельности в научно-технической сфере, отвечающие установленным настоящим Кодексом требованиям к изобретениям и полезным моделям, и результаты интеллектуальной деятельности в сфере дизайна, отвечающие установленным настоящим Кодексом требованиям к промышленным образцам. Контрафактная продукция Контрафактная продукция - продукция, выпускаемая предприятием с нарушением исключительных прав патентообладателей, дизайнеров товарных знаков, авторских прав на тиражирование аудиовидеопродукции, программного обеспечения, баз данных и т.п ИЗМЕНЕНИЯ В ГК РФ (относящиеся к заявкам, поданным после 01.10.2014 ) Статья 1349 пункт 4 часть 4-ая ГК РФ Не могут быть объектами прав: Способы клонирования человека и его клон; Способы модификации генетической целостности клеток зародышевой линии человека; Использование человеческих эмбрионов в промышленных и коммерческих целях; Результаты интеллектуальной деятельности, если они противоречат общественным интересам, принципам гуманности и морали Статья 1350 пункт 1 часть 4 ГК РФ В качестве изобретения охраняется техническое решение в любой области, относящееся к продукту (в частности, устройству, веществу, штамму микроорганизма, культуре клеток растений или животных) или способу (процессу осуществления действий над материальным объектом с помощью материальных средств), в том числе к применению продукта или способа по определенному назначению. Статья 1358 1 Вводится новое понятие - «зависимое» изобретение, полезная модель и промышленный образец «Изобретение, полезная модель, промышленный образец, использование которых в продукте или способе невозможно без использования охраняемых патентом и имеющих более ранний приоритет другого изобретения, другой полезной модели или другого промышленного образца, соответственно являются зависимым изобретением, зависимой полезной моделью, зависимым промышленным образцом Зависимым изобретением, в частности, является изобретение, охраняемое в виде применения по определенному назначению продукта, в котором используется охраняемое патентом и имеющее более ранний приоритет другое изобретение. Изобретение или полезная модель, относящиеся к продукту или способу, также являются зависимыми, если формула такого изобретения или такой полезной модели отличается от формулы другого запатентованного изобретения или другой запатентованной полезной модели, имеющих более ранний приоритет, только назначением продукта или способа. » 9 Статья 1350 пункт 5 часть 4-ая ГК РФ Не являются изобретениями, в частности: 1) открытия; 2) научные теории и математические методы; 3) решения, касающиеся только внешнего вида изделий и направленные на удовлетворение эстетических потребностей; 4) правила и методы игр, интеллектуальной или хозяйственной деятельности; 5) программы для ЭВМ; 6) решения, заключающиеся только в представлении информации. Статья 1375. Заявка на выдачу патента на изобретение 2. Заявка на изобретение должна содержать: 1) заявление о выдаче патента с указанием автора изобретения и заявителя - лица, обладающего правом на получение патента, а также места жительства или места нахождения каждого из них; 2) описание изобретения, раскрывающее его сущность с полнотой, достаточной для осуществления изобретения специалистом в данной области техники; 3) формулу изобретения, ясно выражающую его сущность и полностью основанную на его описании; 4) чертежи и иные материалы, если они необходимы для понимания сущности изобретения; 5) реферат. Статья 1378. Внесение изменений в документы заявки на изобретение, полезную модель или промышленный образец 1. Заявитель вправе внести в документы заявки на изобретение, полезную модель или промышленный образец дополнения, уточнения и исправления путем представления дополнительных материалов по запросу федерального органа исполнительной власти по интеллектуальной собственности до принятия по заявке решения о выдаче патента, либо об отказе в выдаче патента, либо о признании заявки отозванной, если эти дополнения, уточнения и исправления не изменяют заявку на изобретение, полезную модель или промышленный образец по существу. После получения отчета об информационном поиске, проведенном в порядке, установленном пунктами 2 - 4 статьи 1386 настоящего Кодекса, заявитель вправе однократно, по собственной инициативе, представить измененную формулу изобретения, не изменяющую заявку на изобретение по существу, и внести соответствующие изменения в описание. 2. Дополнительные материалы изменяют заявку на изобретение или полезную модель по существу в одном из следующих случаев, если они содержат: иное изобретение, не удовлетворяющее требованию единства изобретения в отношении изобретения или группы изобретений, принятых к рассмотрению, либо иную полезную модель; признаки, которые подлежат включению в формулу изобретения или полезной модели и не были раскрыты в документах заявки, предусмотренных подпунктами 1 - 4 пункта 2 статьи 1375 или подпунктами 1 - 4 пункта 2 статьи 1376 настоящего Кодекса и представленных на дату подачи заявки; указание на технический результат, который обеспечивается изобретением или полезной моделью и не связан с техническим результатом, содержащимся в тех же документах. ПРОДЛЕНИЕ СРОКА ДЕЙСТВИЯ ПАТЕНТА Вступили в действие с 01.01.2015 Продление срока действия исключительного права на изобретение, относящееся к лекарственному средству, пестициду или агрохимикату, для применения которых требуется получение в установленном законом порядке разрешения, и удостоверяющего это право патента. (статья 1363 п.1 ГК РФ) Исключительное право на изобретение и удостоверяющий это право патент действуют при условии соблюдения требований, установленных настоящим Кодексом, с даты подачи заявки на выдачу патента в федеральный орган исполнительной власти по интеллектуальной собственности или в случае выделения заявки (пункт 4 статьи 1381) с даты подачи первоначальной заявки и составляет 20 лет. (статья 1363 п.2 ГК РФ) Если с даты подачи заявки на выдачу патента на изобретение, относящееся к такому продукту, как лекарственное средство, пестицид или агрохимикат, для применения которых требуется получение в установленном законом порядке разрешения, до дня получения первого разрешения на применение прошло более пяти лет, срок действия исключительного права на соответствующее изобретение и удостоверяющего это право патента продлевается по заявлению патентообладателя федеральным органом исполнительной власти по интеллектуальной собственности. Указанный срок продлевается на время, прошедшее с даты подачи заявки на выдачу патента на изобретение до дня получения первого разрешения на применение продукта, за вычетом пяти лет, но не более чем на пять лет. (статья 1363 п.2 ГК РФ) При продлении срока действия исключительного права выдается дополнительный патент с формулой, содержащей совокупность признаков запатентованного изобретения, характеризующую продукт, на применение которого получено разрешение. Процедуры патентования и регистрации лекарственных средств являются самостоятельными и независимыми процедурами. Однако так ли это? Одним из предложений, которое было вынесено для обсуждения на исполнительный комитет Консультативного совета по иностранным инвестициям в России, который курируется Министерством экономического развития, было «не осуществлять государственную регистрацию воспроизведенного лекарственного препарата до истечения срока действия патента на оригинальный препарат». Роспатент исходит из содержания действующих норм российского законодательства. Согласно положениям статьи 1359 ГК РФ одним из действий, нарушающих патент, является «применение, предложение о продаже, продажа, иное введение в гражданский оборот или хранение для этих целей продукта, в котором использовано изобретение…». Государственная регистрация воспроизведенного лекарственного средства (дженерика) не относится к перечисленным в ГК РФ основаниям, свидетельствующим о нарушении исключительных прав. Нарушение патентных прав возможно только в том случае, если зарегистрированное лекарственное средство будет произведено для продажи и храниться с целью оперативного выброса на рынок по истечении срока действия патента. Если же лекарственный препарат был произведен только для прохождения стадий регистрации, то права патентообладателя не будут нарушены. Данная позиция подтверждена Постановлением Президиума ВАС РФ от 16.06.2009 № 2578/09, в соответствии с которым действия с целью подготовки к государственной регистрации и регистрация воспроизведенного лекарственного препарата не являются нарушением патента. Таким образом, упомянутое выше предложение на установление запрета на введение в гражданский оборот воспроизведенного лекарственного средства до прекращения действия исключительных прав на оригинальное лекарственное средство не согласуется с положениями статей 1229 и 1358 ГК РФ, определяющими содержание исключительных прав и порядок использования запатентованного продукта. В качестве превентивных мер при регистрации воспроизведенных лекарственных средств может быть введение требования проверки заявителем патентной чистоты регистрируемого препарата. Иными словами проверки того, могут ли быть нарушены чьи - либо права при выходе препарата на рынок. Подводные камни патентования и регистрации ЛС Первый, вариант простой – это сам патентообладатель зарегистрировал свое изобретение и получил РУ на субстанцию или композицию, указанную в формуле изобретения. Исключительное право, предоставляемое патентом, принадлежит его патентообдадателю и объем этих прав включает характеристики композиции ЛС, указанные в РУ. Второй вариант - сложный. Что будет, если РУ получило лицо, не являющееся патентообладателем и не имеющее исключительных прав на ЛС, охарактеризованное в РУ? Срок действия патента на изобретение, относящееся к лекарственному средству может быть продлен и составлять 25 лет. Может ли об этом знать лицо, ожидающее окончания 20 летнего срока действия патента и готовящееся к этому, в том числе проходя процедуру регистрации? Вполне вероятен случай, когда организация, получив регистрационное удостоверение сроком на 5 лет и подготовив к производству лекарственное средство, узнает, что препятствующий патент продлен на 5 лет. Является ли таким образом получение регистрационного удостоверения напрасным? Не приведет ли такая ситуация к вольному или невольному нарушению патентных прав? Другой «подводный камень» связан с наличием оснований для оспаривания патента в ППС В случае признания патента недействительным частично выдается новый патент на изобретение с уточненной формулой и измененным объемом прав. Этот патент имеет новый номер государственной регистрации и это необходимо учитывать при проведении поиска, так как объем прав на ЛС, определяемый новым патентом, сохраняется, хотя и в ограниченном виде. Еще одним «подводным камнем» является ситуация, связанная со сроком действия патента, поддержанием его в силе путем оплаты пошлин. Согласно статье 1399 Гражданского Кодекса РФ действие патента на изобретение, полезную модель или промышленный образец прекращается досрочно при неуплате в установленный срок патентной пошлины за поддержание патента на изобретение, полезную модель или промышленный образец в силе - со дня истечения установленного срока для уплаты патентной пошлины за поддержание патента в силе. Согласно п.1 статьи 1400 Гражданского Кодекса РФ у патентообладателя имеется право восстановления действия патента, если оно было прекращено по причине неуплаты пошлины за его продление (в течение 3 лет со дня истечения срока уплаты патентной пошлины) Наличие «окон» в периоде действия патента при наличии полного срока его действия позволяет третьим лицам получить так называемое «право послепользования». Согласно п.3 ст. 1400 ГК РФ лицо, которое в период между датой прекращения действия патента на изобретение, и датой публикации в официальном бюллетене сведений о восстановлении действия патента начало использование изобретения, либо сделало в указанный период необходимые к этому приготовления, сохраняет право на дальнейшее его безвозмездное использование без расширения объема такого использования (право послепользования). А.В.Латынцев статьи в «Ремедиум» №4 2015 и в «Фармация» №3 2015 – Правовые аспекты охраны информации о результатах доклинических и клинических исследований Актуальные вопросы экспертизы заявок на изобретения на ЛС Основные объекты изобретений в области фармацевтики: 1) новое химическое соединение, обладающее определенной биологической активностью и являющееся активным началом фармацевтического препарата; 2) способ получения нового химического биологически активного соединения; 3) фармацевтическая композиция; 4)фармацевтическая комбинация 2-х и более активных компонентов 5) лекарственное средство в виде определенной лекарственной формы (препарат), 4) способ лечения с использованием химического биологически активного соединения или композиции на его основе; 5) лекарственное средство на основе растительного или животного сырья; 6) биологически активные добавки; 7) применение веществ, у которых впервые выявлена фармакологическая активность, либо известных лекарственных средств, у которых выявлено новое фармакологическое назначение. Примеры объекта на применение в практике отдела фармацевтики Пример объекта на применение, выраженный через формулу «швейцарского типа» («Применение вещества Х для лечения заболевания Z») Применение гидрохлорида рамозетрона для лечения синдрома раздраженного кишечника с преобладанием диареи у мужчин. Пример объекта на применение, выраженный через признаки производства медикамента («Применение вещества Х для производства медикамента для лечения заболевания Z») Применение гидрохлорида рамозетрона для получения медикамента для лечения синдрома раздраженного кишечника с преобладанием диареи у мужчин. Пример объекта на применение, выраженный с использованием признаков способа лечения («Применение вещества Х для лечения заболевания Z, включающий введение…») Применение гидрохлорида рамозетрона для лечения синдрома раздраженного кишечника с преобладанием диареи у мужчин, включающий введение субъекту суточной дозы рамозетрона от 0,001 до 0,05 мг. Примеры формул, требующих коррекции при проведении экспертизы по существу Неподтвержденный объем притязаний Заявлено: Антилипедимическая композиция, включающая эффективное количество соединения формулы (I) где R1 и R 2, R3 и R4 каждый, независимо обозначает атом водорода, С1-8 алкил, атом галогена, С1-4 алкокси, нитро, тригалогенметил, циано, С1-4 алкилтио, R5 и R 6, каждый, независимо обозначает атом водорода или R5 и R6 вместе с соседним атомом углерода могут образовывать карбоциклическое кольцо; Х обозначает атом серы, атом кислорода или атом азота, кольцо А обозначает циклическую группу, которая может иметь заместитель(и), его производное, или его пролекарство. Выдано: 1. Антилипедимическая композиция, включающая эффективное количество соединения формулы (I) где R1 и R 2, R3 и R4 каждый, независимо обозначает атом водорода, С1-8 алкил или атом галогена; R5 и R 6, каждый, независимо обозначает атом водорода; Х обозначает атом серы или атом кислорода; кольцо А представляет собой бензодиоксол-5-ил или 3,4-дигидро-1Низохинолин-2-ил; его соль, или его сольват. Неподтвержденный объем притязаний Заявлено: Фармацевтическая композиция, содержащая от 0,002 до 0,02 мг гидрохлорида рамозетрона как суточную дозу или эквивалентное молярное количество рамозетрона или другой его фармацевтически приемлемой соли в качестве активного ингредиента. Выдано: Фармацевтическая композиция для лечения синдрома раздраженного кишечника у женщин с преобладанием диареи, содержащая от 0,002 до 0,02 мг гидрохлорида рамозетрона как суточную дозу или эквивалентное молярное количество рамозетрона или другой его фармацевтически приемлемой соли в качестве активного ингредиента . Неопределенные признаки Заявлено: Композиция для лечения заболевания или состояния, включающая таблетку незамедлительного высвобождения, содержащую 400 мг 5-метил-2-(2’-хлор-6’фторанилино)фенилуксусной кислоты или ее фармацевтически приемлемой соли, где таблетка включает между приблизительно от около 60 мас.% и до приблизительно 70 мас.% 5-метил-2-(2’хлор-6’-фторанилино)фенилуксусной кислоты, где упомянутая таблетка незамедлительного высвобождения не содержит достаточного количества нерастворимых в воде полимерных компонентов, чтобы придать упомянутой композиции свойства продленного высвобождения. Выдано: Композиция для лечения воспаления в форме таблетки незамедлительного высвобождения, содержащей 400 мг 5-метил2-(2'-хлор-6'-фторанилино)фенилуксусной кислоты или ее фармацевтически приемлемой соли, где таблетка включает 5метил-2-(2'-хлор-6'-фторанилино)фенилуксусной кислоты или ее фармацевтически приемлемую соль в промежутке между 60 мас.% и 70 мас.%, и поливинилпирролидон, кроскармеллозу в натриевой форме, стеарат магния и микрокристаллическую целлюлозу в количествах, которые обеспечивают высвобождение по меньшей мере около 70% препарата в течение 10 минут. «Нереальный состав» Заявлено: Дезинтоксикационный раствор для проведения диализа, содержащий хлористый кальций, хлористый натрий, хлористый магний, глюкозу при следующем содержании компонентов, г/л раствора: калия хлорид 0,19-0,25; натрия хлорид 2,5-3,8; кальция хлорид 0,1-0,15; магния хлорид 0,02-0,1; вода для инъекций остальное . Выдано: Состав для получения дезинтоксикационного раствора для проведения диализа, содержащий хлористый кальций, хлористый натрий, хлористый магний, глюкозу при следующем соотношении компонентов, г/л раствора: калия хлорид 0,19-0,25; натрия хлорид 2,5-3,8; кальция хлорид 0,1-0,15; магния хлорид 0,02-0,1; вода для инъекций остальное. «Нереальный состав» Заявлено: Средство для дезинфекции, содержащее алкилдиметилбензиламмоний хлорид, водный раствор уксусной кислоты, отличающееся тем, что дополнительно содержит гидроокись натрия при следующем соотношении компонентов, мас.%: алкилдиметилбензиламмоний хлорид 50,0-85,0 водный раствор уксусной кислоты (в пересчете на 70%-ный водный раствор) 34,0-11,0 гидроокись натрия 16,0-4,0. Противоречие ограничительной и отличительной части формулы Заявлено: Крем косметический, содержащий структурообразующие эмульгаторы, масляную фазу, желирующие агенты и нейтрализующие вещества, увлажняющие компоненты, биологически активные добавки, консерванты, парфюмерную композицию и воду питьевую, отличающийся тем, что дополнительно содержит аллантоин, карбамид, масла минеральные, масла растительные, бронитрол или бронопол. Выдано: Крем косметический для сухой кожи, содержащий структурообразующие эмульгаторы, масляную фазу, желирующие агенты и нейтрализующие вещества, увлажняющие компоненты, биологически активную добавку, консерванты, парфюмерную композицию и воду питьевую, отличающийся тем, что в качестве биологически активной добавки содержит аллантоин, в качестве увлажнителя-карбамид, в качестве масляной фазы- масла минеральные и/или масла растительные, в качестве консервантов- бронитрол или бронопол. Экспертиза заявок на изобретения Делопроизводство по заявке 1. Формальная экспертиза 2. Экспертиза по существу с принятием решения: - либо Решение о признании заявки отозванной - либо Решение об отказе в выдаче патента - либо Решение о выдаче патента и его государственная регистрация Экспертиза по существу есть основания для запроса? нет Решение о выдаче патента да направление заявителю запроса есть ответ заявителя? нет Да (экспертиза по существу и решение о выдаче патента Решение о признании или решение об отказе в заявки отозванной выдаче патента) Оспаривание решения в уполномоченном Роспатентом органе и далее, в случае необходимости, в суде (Суд по Интеллектуальным правам) Патентные пошлины Патентные пошлины Ведомства За подачу (регистрацию) заявки За проведение экспертизы по существу За продление срока ответа За выдачу патента и публикацию За подачу возражения EPO 200 € 1165 € (поиск) + 1555 € (экспертиза) 240 € (+ 50% если пропущен срок) 875 € +14 € за каждую страницу свыше 35 1240 € USPTO 280 $ +420 $ за каждый нез. пункт свыше 3 720 $ 200 -3000 $ в зависимости от срока 1780 $ 800 $ JPO 15000 ¥ 118000 ¥ + 4000 ¥ за каждый пункт Нет 2300 ¥+200 ¥ за каждый пункт 49500 ¥+5500 ¥ за каждый пункт DPMA 60 € +30 € за каждый пункт свыше 10 350 € 100 € за каждый месяц 300 € 500 € Роспатент 1650 р. +250р. За каждый пункт свыше 25 2450 р. + 1950 р. за каждый нез. пункт свыше 1 200 р. (до 6 мес.); 400 р. (до 10 мес.) 3250 р. 3250 р. Суммарное количество пошлин за совершение трех действий: за подачу (регистрацию), за проведение экспертизы по существу, за выдачу патента и публикацию (приведенное к рублевому эквиваленту) 180000 160000 140000 Рубли 120000 100000 80000 60000 40000 20000 0 EPO USPTO JPO DPMA Страны Роспатент Патентные и иные пошлины взимаются за совершение юридически значимых действий, связанных с патентованием изобретения, полезной модели, промышленного образца, с государственной регистрацией товарного знака и знака обслуживания, с государственной регистрацией и предоставлением исключительного права на наименование места происхождения товара, а также с государственной регистрацией перехода исключительных прав к другим лицам и договоров о распоряжении этими правами. Пошлины взимаются: -подача заявки -подача ходатайства о проведении экспертизы по существу -внесение изменений в документы заявки после 2-х месяцев с даты подачи заявки -продление срока ответа заявителя -восстановление пропущенного срока ответа -регистрация изобретения -поддержание патента в силе Пошлины не взимаются: -если есть публичное предложение заключить договор об отчуждении патента на изобретение Изобретению предоставляется правовая охрана, если оно является новым, имеет изобретательский уровень и промышленно применимо. Проверка принципиальной патентоспособности 1) При проверке определяется, не исключено ли заявленное предложение из патентной охраны. Для этого определяется, не относится ли заявленное предложение к объектам, которые не могут быть объектами патентных прав, согласно пункту 4 статьи 1349 Кодекса. Если заявленное предложение не относится к указанным объектам, проверяется, может ли оно быть признано относящимся к изобретениям. Для этого определяется, не относится ли заявленное предложение к решению, не являющемуся изобретением в соответствий с пунктом 5 статьи 1350 Кодекса. Проверка принципиальной патентоспосбности Проверка осуществляется с учетом прототипа, выявленного заявителем. Заявленное решение не признается относящимся к изобретениям в смысле положений пункта 5 статьи 1350 Кодекса, в частности, если все признаки, отличающие заявленное решение от его прототипа, являются характерными для решений, которые в соответствии с указанным пунктом не являются изобретениями. Проверка промышленной применимости (Административный регламент по экспертизе п.24.5.1.) возможность использования изобретения в промышленности, сельском хозяйстве, здравоохранении и др., наличие средств и методов, с помощью которых возможно осуществление изобретения в том виде, как оно охарактеризовано в каждом из пунктов формулы изобретения, возможность реализации указанного заявителем назначения. Проверка новизны Проверка новизны изобретения проводится в отношении всей совокупности признаков изобретения, содержащихся в независимом пункте формулы. При наличии в этом пункте признаков, характеризующих иное решение, не считающееся изобретением, эти признаки не принимаются во внимание при оценке новизны как не относящиеся к заявленному изобретению. Проверка изобретательского уровня Не признаются соответствующими условию изобретательского уровня изобретения, основанные, в частности, на выборе оптимальных или рабочих значений параметров, если подтверждена известность влияния этих параметров на технический результат, а выбор может быть осуществлен обычным методом проб и ошибок или применением обычных технологических методов или методов конструирования. ОСОБЕННОСТИ ПАТЕНТОВАНИЯ ЛЕКАРСТВ Некоторые особенности экспертизы заявок на ЛС Упоминание названия ЛС в формуле изобретения – нарушение прав обладателя свидетельства на ТЗ на это ЛС? Фармацевтичечская композиция в форме таблетки, содержащая в качестве активного компонента фумарат бисопролола и вспомогательные вещества, отличающиеся тем, что в качестве вспомогательных веществ содержит Eudragit, бентонит, стеарат магния, микрокристаллическую целлюлозу и лактозу при следующем соотношении компонентов в г: Фумарат бисопролола 2,4 -10,0 Eudragit 10,2- 42,0 Бентонит 4,9 -20,0 Стеарат магния 1,0 -2,0 Микрокристаллическая целлюлоза 21,1 -86,5 Лактоза 9,1- 37,1 Фумарат биоспролола - МНН, то есть правильное использование обозначения. Eudragit- торговое наименование, есть товарный знак. Правильно в этом случае заменить на полиметилметакрилат. П. 24.4 (4) Регламента гласит: При наличии в формуле признаков, имеющих характер словесных, изобразительных или комбинированных обозначений на продукте, являющемся объектом изобретения или используемом в изобретении, относящемся к способу, заявителю дополнительно сообщается о возможности совпадения таких обозначений или сходства их до степени смешения с товарными знаками (знаками обслуживания), которые зарегистрированы или могут быть зарегистрированы другими лицами для товаров одинакового с устройством назначения или соответствующих видов услуг, либо с наименованиями мест происхождения товаров, и, в случае использования изобретения, - к столкновению прав патентообладателя и владельца товарного знака (знака обслуживания), либо к противоправному применению зарегистрированного наименования места происхождения товара. Федеральный закон № 61-ФЗ от 12.04.2010 г. "ОБ ОБРАЩЕНИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ" оригинальное лекарственное средство лекарственное средство, содержащее впервые полученную фармацевтическую су бстанцию или новую комбинацию фармацевтических субстанций, эффективно сть и безопасность которых подтверждены результатами док линических исследований лекарственных средств и клинических ис следований лекарственных препаратов Федеральный закон № 61-ФЗ от 12.04.2010 г. "ОБ ОБРАЩЕНИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ" воспроизведенное лекарственное средство - лекарственное средство, содержащее такую же фармацевтическую субстанцию или комбинацию таких же фармацевтических субстанций в такой же лекарственной форме, что и оригинальное лекарственное средство, и поступившее в обращение после поступления в обращение оригинального лекарственного средства; Изобретением в сфере разработки дженериковых (воспроизведенных) препаратов могут стать: -изобретения на новые препаративные формы известных соединений; -изобретения на новые физические формы соединений; -изобретения на новый способ производства известного вещества; -изобретения на новый способ лечения, основанный на введении известного вещества; -изобретения на медицинское применение известного вещества по новому назначению (второе медицинское применение). БАД – ЛЕКАРСТВО ? БАС БАВ БАД к чему? это составы, а не индивидуальное вещество БАД к пище нутрицевтики ЛС? парафармацевтики БАД природные (идентичные природным) биологически активные вещества, предназначенные для употребления одновременно с пищей или введения в состав пищевых продуктов (ФЗ №29 от 02.01.2000 «О качестве и безопасности пищевых продуктов» статья 1). Пищевые добавки - это природные или синтезированные вещества, преднамеренно вводимые в пищевые продукты с целью придания им заданных характеристик, например для улучшения внешнего вида органолептических свойств пищевого продукта, увеличения срока годности, ускорения сроков изготовления, и не употребляемые сами по себе в качестве пищевых продуктов или обычных компонентов пищи (В.Г. Беспалов, В.Б. Некрасова. Биологически активные добавки к пище // Кафедра, 2000, стр.38-47) Классификация пищевых добавок: Пищевые добавки, обеспечивающие необходимый внешний вид и органолептические свойства продукта (улучшители консистенции, красители, ароматизаторы, вкусовые вещества). Пищевые добавки, предотвращающие микробную или окислительную порчу продуктовконсерванты (антимикробные средства, вкусовые вещества). Пищевые добавки, необходимые в технологическом процессе производства пищевых продуктов (ускорители технологического процесса, разрыхлители, желеобразователи, пенообразователи, отбеливатели). Улучшители качества пищевых продуктов (улучшители муки и хлеба, вещества, препятствующие слеживанию и комкованию, глазирователи, наполнители. БАД Нутрицевтики Парафармацевтики Нутрицевтики – биологически активная добавка к пище, являются источниками пищевых веществ, применяемые для коррекции химического состава пищи человека. Парафармацевтики - это биологически активная добавка к пище, применяемые для профилактики, вспомогательной терапии и поддержки в физиологических границах функциональной активности органов и систем. (В.А. Тутельян и др. Биологически активные добавки в питании человека, Томск, 1999, стр.251-255) А23L - пищевые продукты или безалкогольные напитки А23L 1/03 -пищевые продукты содержащие добавки А23L 1/29 -изменение питательных свойств пищевых продуктов, диетические продукты… A23L 1/30 -изменение питательных свойств пищевых продуктов, диетические продукты содержащие добавки А61К – лекарства и медикаменты для терапевтических, стоматологических или гигиенических целей. ФЗ №38 «О рекламе» от 13.03.2006 статьи 25): 1. Реклама БАД не должна: 1) создавать впечатление о том, что они являются лекарственными средствами и (или) обладают лечебными свойствами; 2) содержать ссылки на конкретные случаи излечения людей, улучшения их состояния в результате применения таких добавок; 3) содержать выражение благодарности физическими лицами в связи с применением таких добавок; 4) побуждать к отказу от здорового питания; 5) создавать впечатление о преимуществах таких добавок путем ссылки на факт проведения исследований, обязательных для государственной регистрации таких добавок, а также использовать результаты иных исследований в форме прямой рекомендации к применению таких добавок. (Санитарно-эпидемиологические правила и нормативы СанПин 2.3.2.1290-03, от 20.06.2003) IV. ТРЕБОВАНИЯ К УПАКОВКЕ БАД И ИНФОРМАЦИИ, НАНЕСЕННОЙ НА ЭТИКЕТКУ 4.4. Информация о БАД должна содержать: - состав БАД с указанием ингредиентного состава в порядке, соответствующем их убыванию в весовом или процентном выражении; - сведения об основных потребительских свойствах БАД; - сведения о противопоказаниях для применения при отдельных видах заболеваний; - указание, что БАД не является лекарством; - информация о государственной регистрации БАД с указанием номера и даты; RU2302877С2, 20.07.2007, А61К35/…: №2302877. Формула Биологически активная добавка к пище для лечения и профилактики дисбактериоза и повышения неспецифической резистентности организма, представляющая собой биомассу штамма Lactobacillus rhamnosus, наращенную в питательной среде, отличающаяся тем, что она в качестве штамма содержит Lactobacillus rhamnosus ВКПМ В-9072, в качестве питательной среды панкреатический гидролизат казеина, дрожжи хлебопекарские прессованные, глюкозу и воду очищенную, при следующем соотношении компонентов, (об.%)… RU 2225210 С1, 10.03.2004, А61К35/…, А61К31/… A23L1/…, : №2225210. Реферат Изобретение относится к рыбной и пищевой промышленности, в частности к биологически активным добавкам (БАД) из морепродуктов, которые могут быть использованы в диетотерапии для профилактики или лечения сердечно-сосудистых заболеваний. БАД содержит пищевой рыбий жир и биологически активные вещества (варианты): концентрат каротиноидов, спиртовой экстракт концентрата фосфолипидов, спиртовой экстракт концентрата фосфолипидов с сапонинами, полученными из морских гидробионтов, таких как кукумария, морские ежи и звезды, сельдь и т.п…. RU2312674 С2, 20.12.2007: формула: Биологически активная добавка для профилактики сердечно-сосудистых заболеваний путем снижения уровня гомоцистеина в крови, выполненная в виде таблетки, содержащей пиридоксина гидрохлорид … отличающаяся тем, что она дополнительно содержит экстракт виноградных косточек при следующем соотношении компонентов… RU2315616 C1, 27.01.2008: формула: Средство для лечения и профилактики сердечнососудистых заболеваний, содержащее этиловый спирт и активное вещество, отличающееся тем, что в качестве активного вещества оно содержит экстракт виноградных косточек или экстракт сосновой коры с содержанием олигомерных проантоцианидинов не менее… RU 2191525,A61L 1/30, 27.10.2002: формула: Биологически активная добавка к пище для профилактики расстройств мочеполовой системы, включающая эхинацею пурпурную и препарат цинка, отличающаяся тем, что в качестве последнего применен цинка оксид и добавка дополнительно содержит корни копеечника забытого, корневища бадана толстолистного, корни лопуха большого, корни солодки… RU 2171106, A61K 9/20, 27.07.2001: формула: Средство для лечения и профилактики воспалительных заболеваний мочеполовой сферы, в том числе хронического простатита, в виде таблетированной формы, включающее ядро, покрытое оболочкой, при этом ядро содержит сухой экстракт смеси равного количества травы зверобоя, травы золотарника канадского, корня солодки и корневища с корнями эхинацеи пурпурной… Благодарю за внимание [email protected]