СН=СН-СН 3 СН 3 СН 2 -СН 2 СН 3 СН 3 СН 3 СН 3 Н е) СН 3
реклама

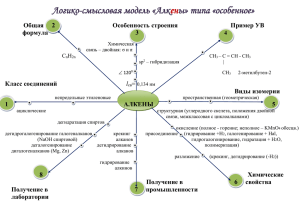
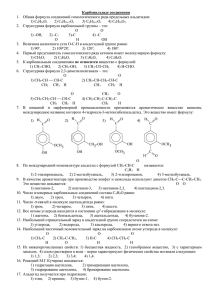
Использование разноуровневых семинаров и ИКТ в профильном обучении химии Материал к выступлению на городском семинаре «ИКТ в обучении» г.Нягань, 2009 г Автор: учитель химии МОУ «СОШ №6» Ким Н.В. Статья «Практика семинаров в профклассе» В МОУ СОШ №6 г Нягань шестой год в 10-11-х классах ведется профильное обучение. Согласно учебному плану в классе естественнонаучного профиля преподавание химии осуществляется по трехчасовой программе. В этих классах учебный процесс предусматривает проведение лекций, семинарских и лабораторных занятий. Особый интерес вызывают у учащихся эффективные формы обучения: уроки-семинары, уроки-лекции, тематические уроки-зачёты, практикумы. В календарно-тематическом планировании органической химии на первое полугодие мною были предусмотрены семинарские занятия. Эти уроки проводились после изучения нового материала наиболее сложных для учащихся тем, таких как: - Порядок соединения атомов в молекулах органических веществ; - Влияние на свойства веществ порядка соединения атомов в молекулах; - Гибридизация электронных облаков; - Гомологический ряд и изомерия и т.д. Разработанные мною семинары являются комбинированными: в программу одного семинара входят теоретические и практические задания. Цель системы семинарских занятий: формирование у учащихся системы знаний, умений и навыков в области органической химии, необходимых для целостного восприятия научной картины мира. Для реализации поставленной цели необходимо решение следующих задач: раскрыть сущность и значение фундаментальных законов, теорий, фактов органической химии; научить применять знания теоретических основ органической химии для характеристики различных классов органических соединений с точки зрения их реакционной способности; развить умения решения расчетных задач; способствовать формированию навыков самостоятельной работы при овладении химическими знаниями. Общеучебная результативность уроков-семинаров состоит в: развитии учебно-организационных умений и навыков, в частности, при работе с различными информационными источниками. На семинарах вырабатывается способностей выделять главное, существенное, составлять конспект и строить рассказ; тренируются умения планировать свою учебную деятельность в отведенный промежуток времени, управлять своим вниманием, наблюдать, запоминать. Развивается логическое мышление, способность выделять признаки для классификации и проводить ее. Учащиеся совершенствуют навык работы в группе; осмысливают результаты своих действий; развивают самоконтроль и взаимоконтроль. Задания каждого семинара сгруппированы в программы, которые дифференцированы по различным уровням трудности «А», «В», «С». С учётом принципа преемственности программы комбинированных семинарских занятий составляю так, что содержание каждой более сложной из них включает в себя знания, умения и навыки, предусмотренные менее сложной программой, но на новом уровне. В программу «С» включаю основные знания по данной теме (не снижая уровень этих заданий ниже требований государственных программ по химии). Основная её цель состоит в том, чтобы направить работу учащихся на овладение знаниями на уровне воспроизведения. Программа «С» - это та ступень, через которую обязательно должны пройти все учащиеся, так как без воспроизведения не может быть осознанных, осмысленных знаний. В этой программе чётко определяем: а) что изучить, что запомнить, какие сделать выводы; б) где конкретно прочитать о том, что необходимо изучить, какую работу с учебником нужно провести; в) какую последовательность операций соблюдать при выполнении опыта или работы с моделями и т.д. Для примера приведём фрагмент программы «С» комбинированного семинарского занятия по теме «SP2- и SP-гибридное состояние атома углерода. π- связь. Изомерия, обусловленная кратными связями». Девиз урока: Всё познаётся в сравнении. Фрагмент программы «С» (уровень-воспроизведение). 1. Прочитайте учебник, § 12, с. 82, § 13, с. 99. Выделите в тексте материал, в котором изложена сущность SP2- и SP-гибридизации электронных облаков. 2. Обратите внимание на следующие вопросы: а) число гибридных и негибридных электронных облаков в атоме углерода в состоянии SP2- и SP-гибридизации; б) значение углов между направлениями гибридных облаков атома углерода в SP2- и SPгибридном состоянии; в) в процессе образования каких углеродуглеродных связей происходит переход атома углерода из SP2- в SPгибридное состояние? 3. Изготовьте шаростержневые модели углеродного скелета, в котором имеется одна π- связь, две π- связи. В программу «В» включаю тот же материал, но уже без каких-либо указаний на методику его изучения. В программу «А» включены задания, предусматривающие свободное самостоятельное оперирование знаниями и умениями, имеющимися в программе «В». Программа «А» развивает творческие способности учащихся, она завершает процесс доведения знаний по теме до осознанного уровня. У учащихся профильного класса, благодаря семинарам, уровень и глубина усвоения таких понятий, как гибридизация, пространственное строение, изомерия, взаимное влияние атомов и групп атомов в молекулах органических соединений выше, чем в других классах этой параллели. У учеников пропал страх, возникающий после изучения новой и трудной для них темы. У них появилась уверенность, что всё недопонятое можно будет проработать на семинаре индивидуально, в удобном и комфортном для них темпе. Образцы семинаров Практическое комбинированное семинарское занятие №6. Тема: Изомерия в органической химии и её виды. Девиз: «Источником самодвижения и развития материи является борьба противоположностей». Программа «А». 1.Для веществ состава С5Н12, С4Н8, С4Н10О начертите структурные формулы всех возможных изомеров (не считая геометрических). Укажите в каждом случае класс органического вещества и вид изомерии. СН3 СН3 2.Сколько веществ изображено: │ │ а) СН3-СН2-СН2-СН3; б) СН3-СН-СН3;в) СН3-СН2-СН-СН2-СН3; г) СН2-СН2; д) СН3-СН-СН=СН2 СН3 │ │ │ │ СН3 СН3 С2Н5 е) СН3-СН=СН-СН-СН3? 3*(проф.). Определите тип гибридизации каждого атома углерода в веществах: а) СН2=СН-С (СН3)=СН-СН3; б) СН3-СН (СН3)-СН=О; в) СН≡С-СН2-СН3. Укажите σ и π связи. Определите степень окисления атомов углерода в последнем веществе. Образцы семинаров Программа «В». 1.Для веществ состава С6Н14, С5Н8, С4Н8О начертите структурные формулы всех возможных изомеров (не считая геометрических). Укажите в каждом случае класс органического вещества и вид изомерии. 2.Сколько веществ изображено: СН3 │ а) СН3-СН=С-СН3; б) СН2-СН2-СН2; в) СН=С-СН3; г) СН3-СН=СН; д) СН3-СН=СН-СН3 │ └ ┘ │ │ │ │ │ СН3 СН2-СН2 СН3 СН3 СН3 СН3 Н е) СН3-С-СН2? └ ┘ Н-С-СН3 3*(проф.). Определите тип гибридизации каждого атома углерода в веществах: а) СН2=СН-СН (СН3)-СН=СН2; б) СН2ОН-СН2ОН; в) СН≡С-С(СН3)3. Укажите σ и π связи. Определите степень окисления атомов углерода в веществе б). Образцы семинаров Практическое комбинированное семинарское занятие №2. Тема: Влияние на свойства веществ порядка соединения атомов в молекулах. Изомерия. Изомерия углеродного скелета. Изомеры. Девиз: Движение материи – это не только перемена места материального объекта, но и изменение его качества, существующих связей между составными его частями, взаимодействия с окружающей средой. Программа «А». 1. Два вещества имеют один и тот же состав – С4Н 10О, но относятся к двум разным классам. Найдите в справочнике их температуры кипения и данные о растворимости. Есть ли различия? Запишите их структурные формулы. Выявите существенный отличительный признак в строении этих веществ. Оперируя знаниями о взаимном влиянии атомов в молекулах, электронном строении молекулы воды, объясните, почему исследуемые вещества имеют приблизительно одинаковую растворимость в воде ( около 8 г в 100 г воды), несмотря на неодинаковое химическое строение их молекул. Образцы семинаров Сравните tкип этих веществ. Постройте гипотезу, в соответствии с которой можно было бы объяснить тот факт, что у спирта tкип выше, чем у эфира. На данных примерах выявите следующие признаки движения материи: а) изменение способов связи атомов; б) изменение качества молекул; в) изменение взаимодействия молекул друг с другом. 2. Запишите структурные формулы трёх возможных изомеров каждого из веществ следующего состава: С5Н12 , С5Н12О. Составьте перечень существенных признаков, по которым отличаются изомеры данных веществ. Выявите причину явления изомерии. На приведённых ранее формулах изомеров докажите, что развитие природы происходит от простого к более сложному. 3. В каком порядке могут соединяться атомы в молекулах вещества, в котором доли углерода, водорода и фтора соответственно равны 0,6316 (или 63,16%), 0,1184 (или 11,84%), 0,2500 (или 25%)? Относительная плотность второго вещества по воздуху равна 2,62. Элективный курс Министерство образования Российской Федерации МУНИЦИПАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 6 (МОУСОШ № 6) МЕХАНИЗМЫ РЕАКЦИЙ В ОРГАНИЧЕСКОЙ ХИМИИ Элективный курс по химии для 10 класса естественнонаучного профиля Составлен: учитель химии МОУСОШ № 6 ___________ /Ким Н.В./ Утверждён: ГорМО учителей химии г. Нягани протокол № 8 от 2007 Элективный курс - лекция Тема занятия: « Ориентация в ароматическом кольце». Цели занятия: изучить виды заместителей – ориентантов в бензольном кольце и их влияние на дальнейшее течение реакций и на получаемые продукты. Ход занятия. Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов. В молекулах, имеющих, только σ-связи взаимное влияние атомов осуществляется через индуктивный эффект. В молекулах, представляющих собой сопряженные системы, проявляется действие мезомерного эффекта. Влияние заместителей, передающееся по сопряженной системе p-связей, называется мезомерным (М) эффектом. В молекуле бензола p-электронное облако распределено равномерно по всем атомам углерода за счет сопряжения. Если же в бензольное кольцо ввести какой-нибудь заместитель, это равномерное распределение нарушается, и происходит перераспределение электронной плотности в кольце. Место вступления второго заместителя в бензольное кольцо определяется природой уже имеющегося заместителя. Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): электронодонорные и электроноакцепторные. Электронодонорные заместители проявляют +М и +I-эффект и повышают электронную плотность в сопряженной системе. К ним относятся гидроксильная группа -ОН и аминогруппа -NH2. Неподеленная пара электронов в этих группах вступает в общее сопряжение с p-электронной системой бензольного кольца и увеличивает длину сопряженной системы. В результате электронная плотность сосредотачивается в орто- и параположениях. Алкильные группы не могут участвовать в общем сопряжении, но они проявляют +I-эффект, под действием которого происходит аналогичное перераспределение p-электронной плотности. Электроноакцепторные заместители проявляют -М-эффект и снижают электронную плотность в сопряженной системе. К ним относятся нитрогруппа -NO2, сульфогруппа —SO3H, альдегидная —СНО и карбоксильная —СООН группы. Эти заместители образуют с бензольным кольцом общую сопряженную систему, но общее электронное облако смещается в сторону этих групп. Таким образом, общая электронная плотность в кольце уменьшается, причем меньше всего она уменьшается в метаположениях: Полностью галогенированные алкильные радикалы (например. - ССl3) проявляют -I-эффект и также способствуют понижению электронной плотности кольца. Закономерности преимущественного направления замещения в бензольном кольце называют правилами ориентации. Заместители, обладающие +I-эффектом или +M-эффектом, способствуют электрофильному замещению в орто- и параположения бензольного кольца и называются заместителями (ориентантами) первого рода. -СН3 +I -ОН +M,-I -NH2 +M,-I -CI (-F,-Вr,-I) +М,-I Заместители, обладающие -I-эффектом или -M-эффектом, направляют электрофильное замещение в мета-положения бензольного кольца и называются заместителями (ориентантами) второго рода: -S03H -М -ССl3 -I -М02 -М,-I -СООН -М -СН=О -М Например,толуол, содержащий заместитель первого рода, нитруется и бромируется в пара- и ортоположения: Нитробензол, содержащий заместитель второго рода, нитруется и бромируется в мета-положение : Помимо ориентирующего действия, заместители оказывают влияние и на реакционную способность бензольного кольца: ориентанты 1-го рода (кроме галогенов) облегчают вступление второго заместителя; ориентанты 2-го рода (и галогены) затрудняют его. Применение. Ароматические углеводороды - важнейшее сырье для синтеза ценных веществ. Из бензола получают фенол, анилин, стирол, из которых, в свою очередь, получают фенолформальдегидные смолы, красители и полистироли многие другие важные продукты. Закрепление: написать уравнения реакций между: а)бензолом и хлором, полученным продуктом и хлорметаном; б) бензолом и азотной кислотой, полученным продуктом и хлорметаном. Практические семинары Большое внимание на уроках и элективных занятиях уделяется отработке практических навыков: составление уравнений и определение их механизма; решение задач на вывод формул; объяснение особенности пространственного строения органических веществ , взаимосвязь строения и свойств. Примером таких работ являются практические семинары, отрывки которых я привела в данной презентации. Задания по теме «Алканы» Обобщение и систематизация знаний по свойствам алканов Составьте уравнения реакций: в) изомеризации: бутана, 2,2-диметилпропана, 3-метилпентана; г) дегидрирования: этана, пропана; Внимание: 1) Изомеризация возможна в присутствии катализатора – Al2O3; 2) дегидрирование проходит при нагревании и в присутствии катализатора – Pt, Pd Составьте уравнения реакций: а) горения: бутана и гексана; б) хлорирования (по 1-ой и 2-ой стадии) пропана, если известно, что замещение протекает у 2-ого атома углерода; в) бромирование метана (по 3-ей и 4-ой стадии); Внимание: 1) при горении всегда получаются CO2 и H2O (возможно и N2, S…); 2) при галогенировании на каждой стадии замещается один атом водорода на один атом галогена у наименее «богатого» водородами атома углерода Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения. Назовите продукты реакции, укажите условия реакций. 1) C2H2Br2 О ↑ // CH4 → C2H2 → CH3 ─ C ↓ \ C2H6 H C2H2Br2 + Br2 О -H2 + H2O // 1)CH4 C2H2 CH3 ─ C +2H2 \ H C2H6 Семинары – решение задач Тема: Решение задач по теме «Строение и реакционная способность органических соединений». Цель: закрепить навыки написания формул, составления названий органических соединений, решения расчетных задач на вывод формулы соединения. 1. Какие вещества являются гомологами? Приведите их структурные формулы. 1.1. этанол и фенол 1.2. 2-нитропропан и 3-нитропропан 1.3. глицерин и этиленгликоль 1.4. бензол и толуол 1.5. бутин-2 и бутен-2 1.6. 2-хлорпропан и 2-хлоргексан 2. 3. Перечислите, какие типы изомерии характерны для соединений: 2.1. 2-метил-3-этилпентан 2.2. пентен-2 2.3. пропанол-1 2.4. 2-гидроксипропановая кислота Приведите формулы изомеров. Назовите. Составьте формулы соединений: 3.1. пентин-2-ол-1 3.2. этилвиниловый эфир 3.3. диметилуксусный альдегид 3.4. бутандион-2,3 3.5. этилпропионат 3.6. этан-1,2-диамин 4. Назовите соединения по рациональной и систематической номенклатуре: 4.1. 4.2. 4.5. 4.3. 4.4. 4.6. 5. Назвать вещество, указать класс 3.1. 3.7. 3.2. 3.8. 3.3. 3.9. 3.4. 3.10. 3.5. 3.11. 3.6. 3.12. 6. Указать тип гибридизации атома углерода в веществах. 6.1. 6.5. 6.2. 6.6. 6.3. 6.7. 6.4. 6.8. Семинарское занятие . Решение задач. Примеры задач. Как изменится скорость образования оксида азота (IV) в соответствии с реакцией 2NO + O2 = 2NO2, если давление в системе увеличить в 3 раза, а температуру оставить неизменной? При повышении температуры на каждые 100С скорость некоторой реакции увеличивается в 4 раза. Как изменится скорость этой реакции при увеличении температуры от 20 до 600С? Имеются три свежеприготовленных образца нестабильного вещества А одинаковой массы. При температуре 200С вещество А в образце полностью распадается за 81 сек, при 400С – за 9 сек. За какое время это вещество распадается в третьем образце при температуре 500С? Скорость реакции этерификации уксусной кислоты метанолом в толуольном растворе (плотность раствора 0,9 г/мл), в котором массовая доля кислоты равна 30,3%, спирта – 7,11% при 700С равна ).144 моль/л.мин. Определите молярные концентрации веществ в растворе, если этерификация будет происходить при 500С в течение 45 минут Температурный коэффициент скорости равен 3. Изменением объема раствора пренебречь. *Скорость реакции ферментативного гидролиза сахарозы не зависит от ее концентрации и прямо пропорциональна концентрации фермента. Для экспериментального определения этой скорости 5 мл раствора сахарозы смешали с равным объемом раствора фермента и выдерживали при 250С в течение 30 мин, затем туда добавили избыток аммиачного раствора оксида серебра и нагрели. Выпало 0,27 г осадка. Определите время, необходимое для гидролиза при той же температуре 50% сахарозы, содержащейся в 4,68 кг ее раствора с плотностью 1,04 г/мл и массовой долей 17,1% после добавления 500 мл такого же раствора фермента. Подготовка к контрольному тесту по теме «Спирты и фенолы» 10 класс к элективному курсу «Механизмы реакций в органической химии», 10 класс Автор: Ким Н.В. учитель химии МОУСОШ №6 г. Нягани ХМАО-Югры, 2008 год. 1. Общая формула предельных одноатомных спиртов: а) СnH3n+1ОH; б) СnHnОH; в) СnH2n+1ОH; г) СnH2n+2ОH. 2. Какая пара веществ является изомерной? а) СН3СН(ОН)СН3 и СН3СН2СН2ОН; б) СН3СН(ОН)СН3 и СН3(CН2)3СН2ОН; в) СН3ОН и C2Н5ОН; г) СН3СН2СН2ОH и CН3СН2СН2СН2ОН. 3. По какой реакции нельзя получить спирт? а) С2Н4 + Н2О ―>… ; б) С5Н11Сl + KOH―> … ; в) СО + 2Н2 ―>… ; г) С2Н6 + Н2О ―>… . Использование образовательных коллекций