Национальный стандарт «Надлежащая клиническая практика»
реклама

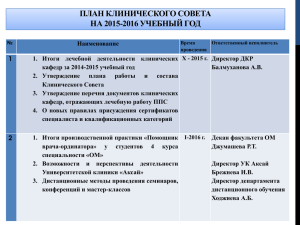
Национальный стандарт «Надлежащая клиническая практика» Завидова Светлана, эксперт по правовым вопросам СПФО Национальный стандарт «Надлежащая клиническая практика» Завидова Светлана, эксперт по правовым вопросам СПФО Разработка стандарта Стимул для разработки: реформа технического регулирования Цель: гармонизация требований к проведению клинических исследований с международными нормами Национальный стандарт Разработчики: AIPM, РАМН, КонфОП; Прошел процедуру, предусмотренную законом «О техническом регулировании» для разработки национальных стандартов; Утвержден Приказом Федерального агентства по техническому регулированию от 27 сентября 2005 года в качестве национального стандарта Национальный стандарт Идентичен тексту Guideline for Good Clinical Practice ICH (ICH GCP) Основная цель Целью национального стандарта является установление единых со странами Европейского Союза, Соединенными Штатами Америки и Японией правил, что должно способствовать взаимному признанию данных клинических исследований уполномоченными органами названных стран Область применения Стандарт необходимо соблюдать при проведении клинических исследований, данные которых запланировано представить в уполномоченные органы Принципы, установленные стандартом, применимы также и к иным клиническим исследованиям, которые могут оказать влияние на безопасность и благополучие человека, выступающего в качестве субъекта Содержание Введение Область применения 1. Термины и определения 2. Принципы надлежащей клинической практики 3. ЭСО/НЭК 4. Исследователь 5. Спонсор 6. Протокол клинического исследования и поправки к протоколу 7. Брошюра исследователя 8. Основные документы для проведения клинического исследования Взаимосвязь с техническим регламентом Планируемая правовая база: Проект технического регламента на лекарственные средства содержит прямую ссылку на национальный стандарт по надлежащей клинической практике Проект технического регламента Включен в Программу разработки технических регламентов на 2004-2006 г., утвержденную распоряжением Правительства РФ от 06.11.2004 г. № 1421р; Разработчик: НП НИТР; Срок внесения в Правительство РФ – декабрь 2006 г. Основа проекта технического регламента Директива 2001/83/ЕС от 6 ноября 2001 г. «О своде законов Сообщества в отношении лекарственных продуктов для человека; Директива 2001/20/ЕС от 4 апреля 2001 г. «О гармонизации законов, правил и административных постановлений государствчленов ЕС, относящихся к применению GCP при проведении клинических исследований медицинских продуктов, предназначенных для применения у человека»; Директива 2005/28/ЕС от 08 апреля 2005 г. Проект технического регламента Глава 3. Клинические исследования Устанавливает требования к проведению КИ, включая ММКИ, а также изучение биодоступности и биоэквивалентности; Не применяется к исследованиям без вмешательства (неинтервенционным исследованиям); Гарантией достоверности результатов КИ, а также дополнительной общественной гарантией безопасности субъектов, защиты их прав и благополучия служит соблюдение стандарта по надлежащей клинической практике. Проект технического регламента результаты клинических исследований, проведенных без соблюдения правил надлежащей клинической практики, не могут быть приняты в качестве доказательства эффективности и безопасности лекарственных продуктов при их регистрации Проект технического регламента Раздел «Клинические исследования» Общие положения Защита субъектов исследования Особенности проведения КИ с участием несовершеннолетних Особенности проведения КИ с участием лиц, признанных недееспособными Особенности проведения КИ с участием дееспособных лиц, состояние которых препятствует самостоятельному волеизъявлению Особенности проведения клинических исследований с участием дееспособных лиц, состояние которых не препятствует самостоятельному волеизъявлению, но не способных собственноручно подписать форму информированного согласия Одобрение клинического исследования комитетом по этике Разрешение на проведение клинического исследования Проект технического регламента Раздел «Клинические исследования» Ввоз на территорию Российской Федерации исследуемых лекарственных продуктов и вывоз с территории Российской Федерации биологических проб для проведения анализа Начало клинического исследования Проведение клинического исследования Приостановка исследования и устранение нарушений Отчет исследователя о нежелательных явлениях Уведомления о серьезных нежелательных реакциях Замечания на проект Замечания на проект технического регламента можно присылать по адресу: [email protected] или [email protected]