Роль стратегии управления рисками в профилактике
реклама

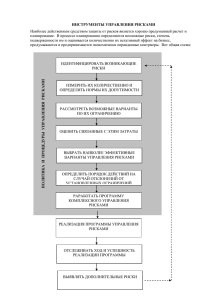
Роль системы управления рисками в профилактике осложнений фармакотерапии А.В. Астахова, В.К.Лепахин Федеральный центр мониторинга безопасности лекарственных средств Современные лекарства подобны атомной энергии - они могут принести как огромную пользу, так и огромный вред. Сэр Деррик Данлоп Первый председатель Комитета по безопасности лекарств Великобритании Рост численности серьезных, а также с летальными исходами НПР • Осложнения лекарственной терапии вышли в США на 4-6место среди основных причин смертности населения • За период с 1998 по 2005 гг. по данным FDA: число сообщений о серьезных НПР при применении рецептурных ЛС увеличилось в США в 2,6 раза (с 34 966 в 1998 г. до 89 842 в 2005) г. • Число летальных исходов, вызванных рецептурными ЛС, увеличилось в 2,7 раза (с 5519 в 1998 г. до 15107 в 2005 г.) • В целом число серьезных НПР (серьезных и летальных) выросло в 4 раза больше, чем число выписанных рецептов Lazarou J и соавт.1998г. Moore TJ, et al. Arch Intern Med 2007;167(16):1752-1759. Статистика • Более 120 ЛС средств отозваны с рынка ЕС за последние 10 лет в связи с проблемами безопасности • 33% из них отозваны в первые 2 года после регистрации • 50% в первые пять лет В базе данных ВОЗ о НПР более 5 000 000 сообщений ≈ 50% из них связаны с нерациональным применением лекарственных средств, медицинскими ошибками и недоучетом особенностей состояния организма больного Динамика поступления сообщений о НПР 2007 г. 2008 г. 2009 г. 2010 1кв. 192 ЛПУ Ф.К. 726 348 1 074 Рег.центры и ЛПУ – 3 336 2 228 В 6 раз Фарм.компании 2 721 6 057 Ожидается поступление 10-12 тыс. сообщений Биопрепараты и их аналоги • Отмечается значительный рост числа биопрепаратов (БП) (Увеличение на 12-15% в год) • В настоящее время на международном рынке – более 200 БП • Около 300 БП - на стадии клинических исследований • БП составляют 22% и 24% от числа всех инновационных препаратов, одобренных соответственно в ЕС и FDA к 2006 году. Особенности биопрепаратов • Природные источники сырья • Видоспецифичность • Сложная структура молекулы • Высокий молекулярный вес • Зависимость активности /безопасности от многих факторов • Разный механизм действия при разных заболеваниях • Сложный процесс производства – трудности воспроизведения партий одного и того же препарата • Сложности тестирования • Выраженная иммуногенность • Канцерогенность Различия между генериками и биоаналогами • «Генерики» биологических продуктов не идентичны, они являются биоаналогами. • Генерик- воспроизведенное лекарственное средство • Генерик идентичен оригиналу по химической структуре, качеству, биоэквивалентности, дозировке, показаниям, профилю безопасности Лекарственные средства на основе нанотехнологий К настоящему времени невозможно предсказать каким будет генетический и биологический ответ только на основании их уникальных необычных свойств Поэтому требуется тщательное изучение безопасности нанотехнологического ЛС в каждом конкретном случае его назначения Система управления рисками (СУР) Совокупность деятельности и мероприятий в области фармаконадзора, направленных на выявление, предотвращение и уменьшение рисков, связанных с ЛС Задачи СУР • Разработка и реализация мер по снижению рисков • Оценка соотношения пользы и риска • Оценка эффективности мер • Коррекция мер в случае необходимости Система управления рисками разрабатывается : • Для новых ЛС • Для новых ЛС при расширении показаний к применению • Для ЛС, в отношении которых появились новые данные о безопасности • По требованию контрольноразрешительных органов JAMA 2008 Oct. 300 (16); 1887-96 Согласно требованиям закона в странах ЕС и США Фармацевтические компании обязаны представить план управления рисками для каждого нового препарата JAMA 2008 Oct. 300 (16); 1887-96 План управления рисками Характеристика безопасности План фармаконадзора Оценка необходимости в дополнительных мероприятиях для уменьшения рисков Директива ЕС: ICHE2E Характеристика безопасности лекарств • По данным доклинических испытаний • По данным КИ • Неблагоприятные побочные реакции на ЛС (выявленные и возможные риски, требующие дополнительного изучения) • Взаимодействия с ЛС и пищевыми продуктами и травами. Основные задачи фармаконадзора в системе управления рисками Выявление рисков Уменьшение рисков Оценка рисков Сообщение о рисках План уменьшения рисков - составная часть плана управления рисками План фармаконадзора Оценка выявленных значимых рисков 1 2 Оценка потенциальных значимых рисков 3 Определение значимой недостающей информации План фармаконадзора основан на: • Характеристике безопасности ЛС • Описании методов фармаконадзора • Плана действий для оценки выявленных проблем безопасности Меры по снижению рисков при применении ЛС • Мед.руководства для специалистов и пациентов, • Разъяснение условий применения ЛС, • Ограничение числа назначаемых ЛС, • Информированное согласие, • Учет врачей, назначающих ЛС • Учет пациентов, получающих ЛС • Маркировка упаковки, • Административные решения (ограничение применения ЛС, изм. дозировок и др.) • Внесение предостережения в инструкцию, • Письма-предупреждения для врачей и пациентов, • Образовательные программы и коммуникационные связи. Меры, принимаемые для снижения рисков Образовательные программы и коммуникационные связи Письма-предупреждения для врачей и пациентов Внесение выделенного предостережения в инструкцию Административные решения по ограничению распространения Ограничение распространения Руководства для медработников и пациентов Разъяснение условий применения ЛС, в том числе путем ограничения числа выписываемых ЛС Информированное согласие Регистрация врачей, назначающих ЛС Регистрация пациентов + Талидомид + + + + + Мизопростол + + Сибутрамин + + Рибавирин + + + + Варениклин + + Мифепристо н + + Препараты + + + Маркировка упаковки + + + + + Изотретинои н + + Мизопростол Misoprostol – синтетический аналог простагландина Е1. Используется для профилактики и лечения язвенной болезни, а также для медикаментозного прерывания беременности на ранних сроках совместно с Мифепристоном. В России зарегистрирован под торговыми названиями: Сайтотек, Миролют, Мизопростол, Мизопростол – ГПМЦ. Серьезные НПР, возникающие при приеме Мизопростола Гиперстимуляция матки с вероятностью ее разрыва. В некоторых случаях требуется гистерэктомия. Мизопростол противопоказан женщинам, имеющим в анамнезе операцию кесарева сечения или рубцы на матке. Длительные и обильные кровотечения в постабортном периоде, требующие стационарного лечения. Вероятность неполных абортов, требующих хирургического вмешательства. По тератогенности мизопростол отнесен к категории «Х», что означает высокую вероятность рождения ребенка с аномалиями развития и уродствами. http://www.accessdata.fda.gov/drugsatfda_docs/label/2002/19268slr037.pdf ЕМЕА рекомендует приостановить действие лицензии на продажу Сибутрамина Сибутрамин – средство для лечения ожирения В ходе исследования SCOUT* было выявлено повышение риска развития серьезных сердечно - сосудистых осложнений Полученные данные имеют большое клиническое значение, т.к. у пациентов с избыточной массой тела и ожирением имеется изначально высокий риск развития сердечно - сосудистых осложнений. Результаты других доступных исследований свидетельствуют о недостаточной эффективности препарата и об отсутствии стойкого эффекта после его отмены. [1] 1. http://www.ema.europa.eu/home.htm *Sibutramine Cardiovascular OUTcomes Административные решения в отношении биопрепаратов В постмаркетинговый период были внесены изменения в инструкции по применению примерно четверти ( 41 из 174) зарегистрированных в странах ЕС и США препаратов Меры по уменьшению рисков включали : 46 писем-предостережений, 19 предостережений, выделенных в черной рамке и 17 – непосредственных встреч с профессионалами Перечень ЛС, в отношении которых разработана СУР (1) • Изотретиноин • Флутиказон • Золпидем • Кломипрамин • Напроксен • Бупропион • Варениклин • Диклофенак • Метформин • Интерферон бета-1б • Эксенатид • Целекоксиб • • • • • • • • • • • • • Микофенолат Мелоксикам Ибупрофен Тамоксифен Норфлоксацин Амиодарон Нортриптилин Пароксетин Пегинтерферон альфа-2а Эпоэтин альфа Ципрофлоксацин Флуоксетин Фентанил • • • • • • • • • • • • • • • Сулиндак Колхицин Метилфенидат Рибавирин Варфарин Панкреатин Дулоксетин Флюразепам Эфализумаб Рибавирин Метоклопрамид Инфликсимаб Метилфенидат Сальматерол Фенопрофен Перечень ЛС, в отношении которых разработана СУР (2) • • • • • • • • • • • • • Тамоксифен Ацитретин Устекинумаб Атомоксетин Будесонид Нилотиниб Имипрамин Тестостерон Топирамид Кеторолак Бозентан Телбивудин Невирапин • • • • • • • • • • • • • Арипипразол Венлафаксин Пимекролимус Этанерцепт Абакавир Икодекстрин Инсулин Гемифлоксацин Пироксикам Офлоксацин Формотерол Адалимумаб Индометацин • • • • • • • • • • • • • • Ритонавир Леветирацетам Телитромицин Мефлохин Лопинавир Ламотриджин Левофлоксацин Флувоксамин Прегабалин Метоклопрамид Мифепристон Эпоэтин – бета Омализумаб Оланзапин Меры, принимаемые для снижения рисков в России • Образовательные программы • Информационные письма, предоставляемые специалистам и в РЦ МБЛС • Предложения по внесению изменений в инструкцию (для принятия административных решений) • Получение информированного согласия пациента • Подготовка рекомендаций по обеспечению безопасности применения ЛС (Варениклин, Сибутрамин, Золпидем) • Ограничение поставок (только в стационары и отдельные аптеки) Одновременное применение нескольких НПВС Пациентке 60 лет, получающей в стационарных условиях терапию по поводу остеохондроза одновременно были назначены: крем «Ортофен» накожно, «Ксефокам» внутримышечно, «Индометацин» ректально. Через 7 дней данной терапии у пациентки развился гипертонический криз с преходящими нарушениями мозгового кровообращения. Примечание ФЦМБЛС: Возможность повышения артериального давления описана в инструкциях по применению данных препаратов. Причинно-следственная связь между применением ЛС и развитием гипертонического криза - вероятная. Одновременное применение нескольких НПВС • Пациентку 32 лет с начала января 2010 года стали беспокоить лихорадка, увеличение лимфоузлов, болевой синдром. Для купирования данных симптомов больная самостоятельно применяла «Анальгин», «Темпалгин» и «Парацетамол». Спустя 1,5 месяца от появления первых симптомов заболевания пациентка была госпитализирована в тяжелом состоянии в стационар с диагнозом: множественная лимфома, гаптеновый агранулоцитоз, лекарственный гепатит. Несмотря на проводимую терапию состояние пациентки ухудшалось, что привело к развитию летального исхода. Письма – предупреждения в региональные центры мониторинга безопасности лекарственных средств, 2009 год № Препарат (МНН и торговое наименование) Наблюдаемые НПР Варениклин (Чампикс) Риск развития нейропсихических реакций 2 Этанерцепт, инфликсимаб Риск развития серьезных инфекций, включая сепсис и туберкулез 3 Микофенолата мофетил (Селлсепт) Риск развития ПМЛ (прогрессирующей мультифокальной лейкоэнцефалопатии) 4 БАДы, содержащие силденафил НПР со стороны сердечнососудистой системы 1 Письма – предупреждения в региональные центры мониторинга безопасности лекарственных средств, 2009 год № Препарат (МНН и торговое наименование) 1 Нейролептики Риск развития венозной тромбоэмболии 2 Варениклин (Чампикс) Руководство для пациентов для профилактики возникновения НПР 3 Тиболон (Ливиал) Риск развития рецидива рака 4 Ампренавир, фосампренавир Риск развития инфаркта миокарда 5 Эфализумаб (Раптива) Приостановления действия лицензии на территории ЕС 6 Мефлохин (Лариам) Риск развития пневмонии, в том числе со смертельным исходом Наблюдаемые НПР, административные меры «Большинству людей кажется, что таблетки – это снайперская пуля, без промаха поражающая мишень. На самом деле она больше похожа на осколочный снаряд, бьющий « по площади» Е.М. Тареев Благодарю за внимание ! Правила управления рисками • • • • Характеристика безопасности План действия по оценке безопасности Рекомендации по уменьшению рисков Оценка результатов по реализации рекомендации. Требования к регистрации биоаналогов • Доказательство сопоставимости с оригиналом • Сопоставимость биоаналогичного продукта рассматривается для: Лекарственного продукта Активной субстанции • Недостаточность сравнения по фармакопейной статье либо другим опубликованным данным Регистрация биоаналогов: Безопасность - клинические и постмаркетинговые исследования • Безопасность должна быть подтверждена для значительного числа пациентов • Изучение иммуногенности • Необходимость предоставления планов управления рисками и фармаконадзора Регистрация биоаналогов • Проведение доклинических и клинических исследований с целью определения разницы в ответах на аналоги и оригинальный препарат • Необходимы клинические исследования для доказательства эффективности • Эффективность и безопасность оригинального продукта подтверждается для каждого из показаний к применению Административные решения в отношении биопрепаратов • В инструкции на 41 биопрепарат из 175, зарегистрированных в США и ЕС, были внесены изменения (за исключением вакцин, аллергенов и продуктов, предназначенных для трансфузии). • 82 административных решения было принято в отношении этих препаратов (46 «писем – предостережений» специалистам, 17 коммуникаций с профессионалами, 19 предостережений в черной рамке JAMA. 2008;300(16):1887-1896. Меры, принимаемые для снижения рисков в России • Образовательные программы • Информационные письма, предоставляемые специалистам и в РЦ МБЛС • Предложения по внесению изменений в инструкцию (для принятия административных решений) • Получение информированного согласия пациента • Подготовка рекомендаций по обеспечению безопасности применения ЛС (Варениклин, Сибутрамин, Золпидем) • Ограничение поставок (только в стационары и отдельные аптеки) Данные меры по снижению рисков при применении ЛС были применены в отношении следующих препаратов: • Изотретиноин • Талидомид • Мизопростол • Сибутрамин • Рибавирин • Варениклин • Мифепристон • Клозапин Заключение В основе фармаконадзора лежат следующие 3 элемента: 1. Оценка выявленных значимых рисков 2. Оценка потенциальных значимых рисков 3. Определение значимой недостающей информации «Большинству людей кажется, что таблетки – это снайперская пуля, без промаха поражающая мишень. На самом деле она больше похожа на осколочный снаряд, бьющий « по плошади» Е.М. Тареев