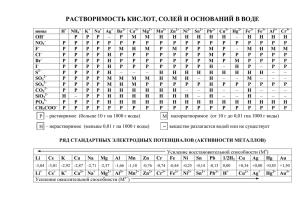
1-testovye-zadanija-dls-samokontrolja-po-teme
реклама

Тестовые задания для самоконтроля по теме «Электрохимические процессы. Ч. 1. Электродные потенциалы» Выберите правильный ответ 1. Самым активным является металл с величиной стандартного электродного потенциала (В): 1. +0,34; 2. +1,20; 3. 0,76; 4. 0,25; 5. 0,44. 2. Не вытесняет водород из раствора НСl металл с электродным потенциалом: 1. 0,13 В; 2. 1,18 В; 3. 0,91 В; 4. +0,80 В; 5. 1,66. 3. Не взаимодействует с водой металл: 1. Ag; 2. Мn; 3. Ni; 4. Fe; 5. Cd. 4. Вытесняет кобальт из раствора CоSO4 металл: 1. Мg; 2. Ni; 3. Sn; 4. Cu; 5. Hg. 5. Никель вытесняет металл из раствора соли: 1. FеSO4; 2. Mg(NO3)2; 3. Pb(NO3)2; 4. AlCl3; 5. Cr2(SO4)3. 6. Отсутствует взаимодействие между сульфатом меди и металлом: 1. Со; 2. Mn; 3. Ni; 4. Pb; 5. Ag. 7. С H2SO4(разб) не взаимодействует металл: 1. Ni; 2. Ca; 3. Mn; 4. Hg; 5. Sr. 8. Не вытесняет водород из раствора хлороводородной кислоты металл: 1. Bi; 2. Sn; 3. Ti; 4. Be; 5. Co. 9. Металл взаимодействует с водным раствором соли в схеме: 1. Ag + K2SO4 → ; 2. Mg + Na2SO4 → ; 3. Mg + CuCl2→ ; 4. Hg + NiSO4 → ; 5. Cu + FeCl2 → . 10. Вытесняют водород из хлороводородной кислоты все металлы ряда: 1. Al, Fe, Cu; 2. Mg, Ca, Hg; 3. Be, Co, Ag; 4. Sn, Ni, Au; 5. Mn, Na, Cd. 11. Стандартный потенциал (В) водородного электрода равен величине: 1. +0,12; 2. 0; 3. 0,44; 4. 0,25; 5. +0,34. 12. Уравнение для расчета электродного потенциала меди в растворе CuSO4 имеет вид: 0,059 0,059 0,590 lg[Cu 2 ] ; 2. Е Е 0 lg[Cu ] ; 3. Е Е 0 ln[Cu 2 ] ; 1 2 2 0 , 059 0 , 590 4. Е Е 0 lg[Cu 2 ] ; 5. Е Е 0 lg[Cu ] . 2 2 1. E E 0 13. Для электрода Cd в 0,1 М растворе CdSO4 уравнение Нернста для расчёта потенциала электрода имеет вид: 1. E = E0 + (0,059/1)lg [10–2]; 2. E = E0 + (0,059/1)lg [10]; 3. E = E0 + (0,059/2)lg [10–1]; 4. E = E0 (0,059/2)lg [10–2]; 5. E = E0 + (0,059/2)lg [10–2]. 14. Максимальный электродный потенциал возникает при погружении серебра в раствор с концентрацией ионов Ag+, равной величине (моль/л): 1. 0,1; 2. 1; 3. 10; 4. 0,01; 5. 0,0001. 15. Равновесный потенциал оловянного электрода равен стандартному потенциалу при концентрации ионов Sn2+, равной величине (моль/л): 1. 0,1; 2. 1; 3. 10; 4. 0,001; 5. 0,0001. 16. Анодом для железного электрода может служить электрод из металла: 1. Pb; 2. Ni; 3. Mg; 4. Ag; 5. Co. 17. Катодом для никелевого электрода может служить электрод из металла: 1. Sn; 2. Fe; 3. Mn; 4. Al; 5. Cd. 18. В гальваническом элементе Zn | Zn(NO3)2 || Pb(NO3)2 Pb на катоде протекает процесс: 1. Pb – 2ē = Pb2+; 2. Pb2+ + 2ē = Pb; 3. Zn2+ + 2ē = Zn; 4. Zn – 2ē = Zn2+; 5. 2NO3 – 2ē = 2NO2 + O2. 19. В гальваническом элементе Mg | Mg2+ || Al3+ | Al на аноде протекает процесс: 1. Al – 3ē = Al3+; 2. Al3+ + 3ē = Al; 3. Мg – 2ē = Mg2+; 4. 2H+ + 2ē = H2; 5. Mg2+ + 2ē = Mg. 20. В гальваническом элементе Zn | HCl Ni на катоде протекает процесс: 1. Ni – 2ē = Ni2+; 2. 2H+ + 2ē = H2; 3. Zn2+ + 2ē = Zn; 4. Zn – 2ē = Zn2+; 5. Ni2+ + 2ē = Ni.