Черкашина Людмила Ивановна, учитель химии, СОШ № 32, г. Караганда,
реклама

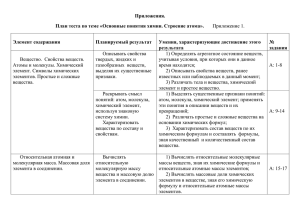
Черкашина Людмила Ивановна, учитель химии, СОШ № 32, г. Караганда, Казахстан Урок – обобщения по теме: «Периодический закон и Периодическая система химических элементов Д.И.Менделеева». Цели: 1) Обобщить и углубить знания учащихся по теме. Проверить степень усвоения материала. 2) Стимулировать познавательную активность учащихся, развивать интерес к предмету, смекалку, эрудицию, умение быстро и чётко формулировать и высказывать свои мысли, логически рассуждать, применять свои знания на практике. 3) Воспитывать чувство сопричастности общему делу, умение работать в коллективе. Оборудование и реактивы: Таблицы Периодической системы Д.И. Менделеева, Вернера, Н. Бора, Некрасова и другие виды таблиц. Химические стаканы (2 шт.) с водой, порошок магния и металлический натрий (или калий и кальций). Высказывание Д.И. Менделеева о Периодической системе химических элементов: «Периодическому закону будущее не грозит разрушениям, а лишь надстройки и развитие обещает». «Элементы и атомы, В Менделеевский взятые круг, Сделали химию самой богатой И самой творческой из наук». Г. Санников. Тип урока: урок контроля и коррекции знаний, умений и навыков. Методы и приёмы: беседа, самостоятельная работа с перфокартами, текстами, лабораторные эксперименты, самоконтроль и самооценка, работа с тестовыми заданиями, работа с ПСХЭ. Девиз: «Свои способности человек может узнать, только попытавшись приложить их». Сенека. Ход урока: I. Организационный момент. Приветствие учащихся и гостей. Знакомство с организационной структурой: сегодня мы с вами должны обобщить знания, которые вы получили при изучении темы: ПЗ и ПСХЭ. Проведём этот урок в нетрадиционной форме. Класс поделен на 5 групп. В каждой группе есть капитан, который будет фиксировать работу каждого игрока команды в листе – учёта. В качестве критерия берутся правильность учеником части работы и его вклада в работу группы. Класс делится на группы по 5 человек. Каждая группа получает свой маршрутный лист. Ф.И. ученика 1. 2. Задание, баллы 1 – ое 2 – ое 3-е 4 – ое итого оценка 5 – ое Мной будет оценено1–ое задание (работа на перфокарте), а каждый из вас проведёт самоконтроль тестового задания и поставит себе оценку. II. Мотивация. Сегодня вы должны показать, что умеете пользоваться ПСХЭ. Д.И. Менделеева. С помощью таблицы вы должны уметь давать характеристику элементу по его положению в ПС, составлять формулы оксидов и гидроксидов. Но прежде, чем перейти к 1– ому заданию нам необходимо ответить на некоторые вопросы (3 мин.). 1. Как Д.И. Менделеев сформулировал периодический закон? 2. Какова современная формулировка ПЗ? 3. Что такое период, группа? 4. Каков физический смысл порядкового номера, номера группы, номера периода? 5. Как изменяются свойства химических элементов и их соединений в периодах, в группах? Настало время для выполнения первого самостоятельного задания: «Расскажите мне обо мне». Сейчас вы должны дать характеристику химическому элементу в соответствии с планом характеристики элемента. (На партах в конвертах лежат перфокарты. Учащиеся подписывают фамилию и работают самостоятельно в течение 4-5 минут) Характеристика элемента. 1. Знак элемента. 2. Название. 3. Порядковый номер. 4. Номер. а) периода б) ряд в) группа г) подгруппа 5. Заряд ядра. е р n0 6. Электронная конфигурация. 7. Свойство простого вещества (металл неметалл). 8. Валентность атома. 9. Формула высшего оксида, гидроксида, л.в.с. и их характер. Обратимся к высказыванию великого русского учёного – химика Д.И. Менделеева: «Периодическому закону будущее не грозит разрушением, лишь надстройки и развитие обещает». Мы знаем, многие учёные до Менделеева и после, пытались классифицировать элементы. Ни одна из попыток не привела к созданию системы, отражающей взаимосвязь элементов и выявляющей природу их сходства и различия. Открытие периодического закона и построение периодической системы химических элементов – заслуга великого русского учёного Д.И. Менделеева. И мы до сих пор пользуемся именно этим вариантом ПС. Кроме школьной таблицы (короткая форма) существует много других видов таблиц: длинопериодный вариант, лестничный, спиральный и. т. д. Чем должна определяться правильность составления этих таблиц? (Форма периодической системы м/б разной, но в любом случае она отражает одни и те же взаимосвязи групп химических элементов). А для того, чтобы доказать правоту учёного мы переходим к следующему заданию. Вам предложены листы-рассказы. Заполните пропуски в листе. Например, 1. Периодический закон читается так: … 2. Периодическая система – это … 3. Периодом называется … 4. Периодов в периодической системе … , из них: а) малых … б) больших… в) незаконченных … и т.д. Затем один представитель от команды зачитывает своё задание. ( Для пяти групп раздаются разные варианты листов. В течение 1 минуты группа работает над листом - рассказа. После один представитель от команды зачитывает своё задание) На демонстрационном столе стоят реактивы. На основании структуры таблицы проведите и проанализируйте 2 опыта. 1. Взаимодействие Na с H2O 2. Взаимодействие Mg с H2O Сделайте вывод от изменения свойств простых веществ, образованных химическими элементами одного периода, расположенного в порядке возрастания Ar. В следующем задании «Мои соседи», укажите знаком (стрелочкой ) ослабление металлических свойств и усиление неметаллических в следующих пятёрках. Объясните, на каком основании расставлены знаки. Ge I 1) In Sn Sb; Se Br Kr. Pb Cl Sr O 2) K Ca Sc; Cl S P Mg Se Si At 3) As Ge Ga; Xe I Te Sn Br Be As 4) Al Mg Na; Si P S Ca N Ga S 5) Mg Al Si; Br Se As B Te Посмотрите внимательно на схему и озвучьте её. Схема: «Строение атома». Число протонов = Общее число электронов (е) Атом электронейтрален ( 11 р) Заряд ядра ё. Ядро) 1/1840а.е.м. )) Внешний слой N ≤ 8 е 4 е – 7 е – неметаллы; 1 е – 3 е – металлы; внутренние слои ( N = 2n² ) 1 1 8 е – инертные химические элемент р n 1 0 Масса атома Один человек из любой группы выходит к доске и «озвучивает схему». Каждой группе даётся карточка с описанием неизвестного элемента и просто вещества, образованного этим элементом. Учащиеся должны определить принадлежность к одной из классификационных групп (металлы, неметаллы) на основе указанных свойств элементов. Например: Высшая валентность по кислороду 3. Простое вещество имеет характерный металлический блеск. Проводит тепло и электричество, твёрдое, серебристо-белого цвета. Оксид и гидроксид проявляют амфотерный характер. Мы убедились в гениальности предсказаний Д.И. Менделеева. Как много интересного и важного могут дать нам его закон и система! Вся химия, разветвляясь во все области человеческой жизни, корнями уходит в периодический закон. Настало время для последнего задания. «Составь код». (см. приложение). (Учащиеся отвечают на 10 вопросов теста. Затем проверяют тесты и выставляют оценки.) 10 вопросов – «5»; 8-9 вопросов – «4»; 6-7 вопросов – «3»; 4-5 вопросов – «2». 3. Рефлексия, итоги урока. Вот и заканчивается наше занятие, и закончить его хочется такими словами Г. Санникова: «Элементы и атомы, В менделеевский взятые круг, Сделали химию самой богатой И самой творческой из наук». Рефлексию провожу по принципу незаконченного предложения. Каждому даются листы, учащиеся заканчивают предложения. 1. На сегодняшнем уроке я закрепил знания... 2. На сегодняшнем уроке я научился… 3. После сегодняшнего урока я уже не сделаю ошибку… Приложение. Тестовая работа. I вариант. 1. Найдите среди следующих химических элементов такой, у которого округленная атомная масса равна 23, и ядро атома содержит 11 протонов. 51 11 23 24 а) V, б) В, в) Na, г) Mg. 23 5 11 12 2. Какая формулировка периодического закона является современной? а) свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины из атомной массы. б) свойства химических элементов, а также формы и свойства, образуемых или простых веществ и соединений находятся в периодической зависимости от величины зарядов их атомных ядер. 3. На основании проведенных электронных схем атомов химических элементов определите, какие из этих химических элементов находятся в 3 периоде? а) 2, 3. б) 2, 8, 3. в) 2, 8, 4. г) 2, 8, 8, 2. д) 2, 8, 18, 3. 4. Определите, какие химические элементы, электронные схемы которых приведены ниже, находятся рядом в таблице периодической системы. а) 2. б) 2, 3. в) 2, 8, 4. г) 2, 7. д) 2, 8, 8, 2. е) 2, 8, 8. ж) 2, 8, 5. 5. Найдите электронную формулу атома химического элемента, который расположен во 2 периоде, 1 группе. а) 1S² 2S¹; б) 1S² 2S² 2р3 ; в) 1S² 2S² 2р4 ; г) 1S² 2S² 2р6 . 6. С увеличением заряда ядер атомов в ряду Li Na K Rb металлические свойства а) усиливаются б) ослабевают в) не изменяются г) изменяются периодически. 7. Электронная формула атома углерода. а) 1S² 2S² 2р6 ; б) 1S² 2S²; в) 1S² 2S² 2р4 ; г) 1S² 2S² 2р2 . 8. В главных подгруппах (А – группах) периодической системы химических элементов с увеличением заряда ядер не изменяется. а) радиус атома; б) число энергетических уровней; в) общее число электронов; г) число электронов на внешнем энергетическом уровне. 9. Наиболее ярко выраженные неметаллические свойства среди элементов 2 периода периодической системы проявляет: а) бор; б) углерод; в) азот; г) кислород. 10. Формулы высших оксидов серы, азота, хлора соответственно: а) SO3, N2O5, Cl2O7; б) SO2, N2O5, Cl2O7; в) SO3, N2O3, ClO2; г) SO2, NO2, Cl2O7.