Тематическое планирование уроков в 9 классе по учебнику В.В
advertisement
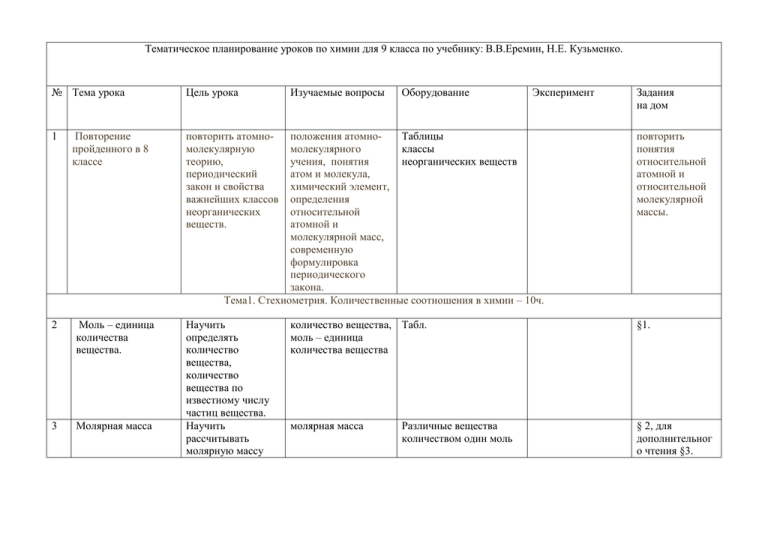
Тематическое планирование уроков по химии для 9 класса по учебнику: В.В.Еремин, Н.Е. Кузьменко. № Тема урока 1 Повторение пройденного в 8 классе 2 Моль – единица количества вещества. 3 Молярная масса Цель урока Изучаемые вопросы Оборудование повторить атомномолекулярную теорию, периодический закон и свойства важнейших классов неорганических веществ. Эксперимент положения атомноТаблицы молекулярного классы учения, понятия неорганических веществ атом и молекула, химический элемент, определения относительной атомной и молекулярной масс, современную формулировка периодического закона. Тема1. Стехиометрия. Количественные соотношения в химии – 10ч. Научить определять количество вещества, количество вещества по известному числу частиц вещества. Научить рассчитывать молярную массу Задания на дом повторить понятия относительной атомной и относительной молекулярной массы. количество вещества, Табл. моль – единица количества вещества §1. молярная масса § 2, для дополнительног о чтения §3. Различные вещества количеством один моль вещества по числу молей вещества. Научить производить расчеты по уравнениям химических реакций. 4 Расчеты по уравнениям реакций 5 Расчеты по уравнениям реакций – решение задач отработка навыков проведения расчетов по уравнениям химических реакций. 6 Закон Авогадро. Молярный объем газа. 7 Относительная плотность газов рассчитывать количество вещества газа и число молекул исходя из объема газа при н. у. уметь пользоваться понятием относительной плотности, определять по основной закон стехиометрии (отношение количеств реагирующих веществ равно отношению соответствующих коэффициентов в уравнении реакции) основной закон стехиометрии (отношение количеств реагирующих веществ равно отношению соответствующих коэффициентов в уравнении реакции) закон Авогадро, молярный объем газа, нормальные условия (н. у.) относительная плотность газов. §4 §4, для дополнительног о изучения §5 Модель молярного объема газа, табл. §6 § 7. 8 Расчеты по уравнениям химических реакций с участием газов 9 Тепловые эффекты химических реакций 10 Решение задач различных типов 11 Контрольная работа 1 формуле газа, насколько он тяжелее или легче воздуха. Научить производить расчеты по уравнениям химических реакций с участием газов. Научить производить расчеты по уравнениям термохимических реакций. Научить производить расчеты по уравнениям химических реакций. отношение объемов двух газов равно отношению количеств вещества этих газов шары, наполненные водородом, воздухом и углекислым газом. §8 тепловой эффект реакции, экзотермические и эндотермические реакции, термохимическое уравнение реакции отработать навыки решения расчетных задач различных типов с целью подготовить учащихся к контрольной работе таблицы § 10. экзотермическая (разложение дихромата аммония) и эндотермическая (разложение малахита) реакции. §9 для дополнительног о чтения, самое важное в главе 1. Тема 2. Химическая реакция (13 часов) 12 Электролиты и неэлектролиты. Электролитическая диссоциация Дать понятия электролит, неэлектролит, объяснить причину электропроводност и водных растворов солей кислот и щелочей Дать представление об общих свойствах кислотных и щелочных растворов как свойствах ионов водорода и гидроксила Дать понятия о сильном и слабом электролитах. 13 Диссоциация кислот, солей и оснований 14 Сильные и слабые электролиты. Степень диссоциации 15 Кислотность среды. Научить Водородный пользоваться показатель понятиями электролит, неэлектролит, объяснять причину электропроводност и водных растворов солей кислот и электролит, неэлектролит, электролитическая диссоциация Табл.Электропроводност ь водных растворов различных веществ, электропроводность расплава калийной селитры. Изучение § 11. электропроводност и растворов и движения ионов в электрическом поле определения понятий кислота, основание и соль с позиций теории элеткролитической диссоциации Демонстрация общих химических свойств кислот (щелочей). сильный электролит, слабый электролит, степень диссоциации. Возрастание § 13. электропроводност и уксусной кислоты при разбавлении раствора. Определение §14. кислотности среды универсальным индикатором кислотность среды. Водородный показатель. Измерение кислотности среды. раствор соды, средство для мытья посуды, стиральный порошок, мыло и продукты питания (молоко, соки, кефир, лимонад). §12. 16 Реакции ионного обмена и условия их протекания. 17 Составление ионных уравнений реакций 18 Практическая работа 1. Решение экспериментальных задач по теме "Электролитическа я диссоциация" Решение задач по теме "Электролитическа я диссоциация" 19 20 Окисление и восстановление щелочей. Научить пользоваться понятиями электролит, неэлектролит, объяснять причину электропроводност и водных растворов солей кислот и щелочей. Научить составлять полные и краткие ионные уравнения реакций. Научить составлять молекулярные уравнения реакций по сокращенному ионному уравнению Дать понятия окисление, восстановление, условия протекания реакций обмена в ратсворах Изменение электропроводности при нейтрализации раствора гидроксида бария серной кислотой Реакции обмена в водных растворах электролитов § 15. отработка навыков составления ионных уравнений реакций. § 15, § 16 для дополнительног о чтения, подготовиться к практической работе. разобрать протекание реакций обмена в растоврах кислот, оснований и солей на конкретных примерах. §§ 11-15, самое важное в главе 2. окисление, восстановление, окислитель, восстановление оксида меди(II) водородом § 17. 21 Составление уравнений окислительновосстановительных реакций. Электронный баланс 22 Электрохимически й ряд напряжений металлов. . 23 Электролиз. окислитель, восстановитель, выяснить причину окислительновосстановительных реакций. Научить анализировать окислительновосстановительный процесс, определять направление перехода электронов Научить учащихся пользоваться элеткрохимическим рядом напряжений металлов, дать понятия о процессах, происходящих при работе гальванического элемента. Сформировать понятие о сущности процессов, протекающих при прохождении электрического тока через растворы восстановитель, окислительновосстановительная реакция расстановка коэффициентов методом элеткронного баланса, умение Восстановление перманганата калия сульфитом натрия или пероксидом водорода в различных средах. Окислительновосстановительные реакции § 18, § 19 для дополнительног о чтения гальванический элемент, электрод, катод, анод, электрохимический ряд напряжений металлов. работа медноцинкового гальванического элемента § 20. электролиз Изучение § 21, §22 для электропроводност дополнительног и растворов и о чтения. движения ионов в электрическом поле и расплавыы электролитов. 24 Контрольная работа. Тема 3. Химия неметаллов (22ч) 25 Общая характеристика галогенов 26 Хлор – распространенност ь в природе, физические свойства и получение в лаборатории 27 Химические свойства хлора 28 Применение хлора. Получение хлора в промышленности дать общую характеристику подгруппы, формулировать важнейшие свойства галогенов Сформировать представление о хлоре как о химическом элементе и простом веществе. Познакомить учащихся химическими свойствами хлора Познакомить с важнейшими областями применения хлора и способами его получения в промышленности галогены § 23. знать физические свойства хлора, способы его получения, его токсичность, уметь оказывать первую медицинскую помощь при отравлении хлором химические свойства хлора § 24,25 Применение хлора и получение его в промышленности § 28. § 26, § 27 для дополнительног о чтения. 29 Хлороводород. Соляная кислота Сформировать хлороводород представление о свойствах хлороводорода и его водного раствора – соляной кислоты, научить проводить качественную реакцию на хлоридион. 30 Практическая работа 2. Экспериментальное решение задач по теме "Галогены". экспериментальные навыки по обращению с соединениями галогенов. 31 Общая характеристика халькогенов Сформировать понятия о закономерностях изменения свойств элементов (радиус атома, электроотрицательн ость) и свойствах простых веществ (неметаллические и окислительные свойства) в подгруппе кислорода общая характеристика подгруппы кислорода Получение хлороводорода действием серной кислоты на поваренную соль, растворение хлороводорода в воде ("фонтанчик"), иземенение окраски индикаторов, качественная реакци на хлоридион §§ 29, 30. § 31 для дополнительног о чтения § 32. 32 Кислород. Озон — аллотропная модификация кислорода Дать понятия о свойствах кислорода, явлениях аллотропии Дать понятие скорости применительно к хиимческим являениям Кислород – простое вещество, его свойства, аллотропия 33 Скорость химических реакций 34 Сера Дать знания о важнейших свойствах серы сера как химический элемент и простое вещество 35 Сероводород. Сульфиды свойства сероводорода и его солей § 38. 36 Сернистый газ сернистый газ, кислотные дожди § 39. 37 Серный ангидрид и серная кислота Сформировать представление о сероводороде и сульфидах Сформировать представление о сернистый газ, кислотные дожди Познакомить с химическими свойствами серной кислоты, способом разбавления концентрированны х растворов серной кислоты, научить скорость химических реакций, факторы, влияющие на скорость реакции, катализатор концентрированная, серная кислота, качественная реакция на сульфатион 33 Действие соляной кислоты на мрамор при различных концентрациях HCl и различных температурах. Горение сахара в прсиутствии солей лития (катализатор). Плавление серы, получение пластической серы, взаимодействие серы с железом. взаимодействие концентрированной серной кислоты с медью и сахарозой Изучение факторов, § 34. влияющих на скорость химической реакции §§ 36, 37. Изучение свойств серной кислоты и ее солей § 40 38 39 40 41 проводить качественную реакцию на сульфат-ион Практическая Сформировать работа 3. экспериментальные Экспериментальное навыки по решение задач по обращению с теме "Подгруппа соединениями кислорода". серы, умение проводить качественную реакцию на сульфат-ион Азот. Дать общую характеристику элементов подгруппы азота Аммиак – строение Познакомить со молекулы, свойствами физические и аммиака, объяснить химические образование свойства ковалентной связи по донорноакцепторному механизму. Получение и Познакомить применение методами аммиака. Соли получения и аммония областями применения аммиака, сформировать Азот – простое вещество, связывание молекулярного азота аммиак, донорноакцепторный механизм образования ковалентной связи, соли аммония §§ 41 – 43. растворение аммиака в воде ("аммиачный фонтан"), взаимодействие аммиака с хлороводородом ("дым без огня"), горение аммиака в кислороде. Получение и Разложение хлорида применение аммиака. аммония в трубке, Соли аммония расположенной наклонно; разложение дихромата аммония Изучение свойств водного раствора аммиака § 44 Свойства солей аммония §§ 45, 46. 42 43 представление о строении и свойствах солей аммония. Сформировать Практическая экспериментальные работа 4. навыки по Получение аммиака получению и изучение его аммиака и свойств изучению его свойств Азотная кислота Дать знания об особенностях реакций азотной кислоты с металлами 44 Химическое равновесие 45 Фосфор и его Дать понятие о химическом равновесии, научить предсказывать направление смещения равновесия в соответствии с принципом ЛеШателье Познакомить азотная кислота Взаимодействие с медью концентрированной и разбавленной азотной кислоты, вспышка скипидара с дымящей азотной кислотой, взаимодействие угля с расплавленной селитрой, разложение нитратов свинца и серебра §48, § 47 для дополнительног о чтения Химическое равновесие, принцип Ле-Шателье 49 фосфорный 50-52 соединения 46 Минеральные удобрения 47 Практическая работа №5 Экспериментальное решение задач по теме «Элементы подгруппы азота» Углерод как химический элемент и простое вещество. Аллотропия углерода. Химические свойства углерода 48 49 50 Углекислый газ учащихся свойствами фосфорного ангидрида и ортофосфорной кислоты Сформировать представление о минеральных удобрениях ангидрид, фосфорные кислоты, фосфаты азотные, калийные, фосфорные удобрения коллекция минеральных удобрений Изучение свойств минеральных удобрений 53 Гл 6 Познакомить учащихся с углеродом, его аллотропной модификацией углерод и его аллотропные модификации: алмаз, графит Знания о важнейших химических свойствах углерода, о токсичности угарного газа важнейшие свойства углекислого газа, его химические свойства углерода Углекислый газ, его свойствва Шаростержневые модели кристаллических решеток 54, 55, 56 57,58 Получение углекислого газа, наполнение им сосуда. 59 51 Практическая работа №6 «Получение углекислого газа и изучение его свойств» 52 Угольная кислота и ее соли. 53 Кремний и его соединения. 54 Контрольная работа №3 физиологическое действие, уметь определять наличие значительных количеств углекислого газа в исследуемой емкости. Сформировать экспериментальные навыки по получению углекислого газа и изучению его свойств, уметь отличать углекислый газ от воздуха. Сформировать представление об угольной кислоте, его солях свойствах Дать знания о кремнии и его соединениях, их свойствах, применении Переливание углекислого газ аиз одного сосуда в другой. Тушение пламени. Горение магния в углекислом газе. угольная кислота, карбонаты, стиральная и питьевая сода Знакомство с образцами природных карбонатов. кварц, кремниевая кислота, силикаты, стекло Ознакомление с образцами прородных силикатов. Коллекция "изделия из стекла". Качественная реакция на карбонат-ион, изучение свойств среднего и кислого карбонатов натрия Получение осадка кремниевой кислоты и нерастворимых силикатов. 60,61 63, 64,62,65,гл 7 55 Общие свойства элементов – металлов. Физические свойства. 56 Химические свойства металлов 57 Получение и применение металлов 58 Контрольная работа №4 Сформировать знания о физических свойствах элементов – металлов, их физических свойствах Сформировать знания о химических свойствах металлов, научить сопоставлять различные металлы по химической активности. Сформировать знания об основных методах получения металлов и важнейших областях применения металлов и сплавов Общие свойства металлов(4) металлы, Коллекция "Металлы и металлическая связь сплавы" Химические свойства металлов металлургия, методы получения металлов Изделия из металлов и сплавов. Ознакомление с физическими свойствами металлов 75 -77 Химические свойства металлов 78 79, гл Основы органической химии (7 ч) 59 Многообразие органических веществ и Сформировать представление о причинах теория строения органических веществ, Табл. изомерия 66,67 особенности их строения 60 Углеводы 61 Природные источники углеводородов 62 Спирты разнообразия органических веществ, понятие о изомерии Научить составлять формулы алканов, объяснять понятия об изомерии и гомологии на примере алканов Дать знания об основных природных источниках углеводородов, сформировать представление о важнейших процессах их переработки. классификация органических веществ, изомерия, гомологический ряд предельные углеводороды (алканы) дать общее представление о классе спиртов, познакомить учащихся с важнейшими представителями веществ этого класса – этиловым спиртом и глицерином. Табл. алканы 68,70 нефть, перегонка нефти, крекинг нефти, природный газ, каменный уголь. Коллекции "Нефть и продукты ее переработки", "Полимеры". 69, 70 для дополнительног о чтения. спирты, этиловый спирт (этанол), глицерин Качественная реакция на многоатомные спирты 71 63 Углеводы Познакомить с представителями класса и их свойствами углеводы, глюкоза, сахароза, крахмал, целлюлоза 64 Карбоновые кислоты. Жиры карбоновые кислоты, уксусная кислота, стеариновая кислота. Жиры 65 Аминокислоты. Белки 66 Резервное время. Повторение, обобщением курса ознакомить учащихся с классом карбоновых кислот, со сложными эфирами и жирами Сформировать представление о строении белков Обобщение, повторение темы аминокислоты, белки Образцы различных углеводов приготовление крахмального клейстера, качественная реакция на крахмал Изучение свойств уксусной кислоты 72 денатурация белка 74, гл 8 73



