Денисова В.Г. Решение заданий занятия № 4
реклама

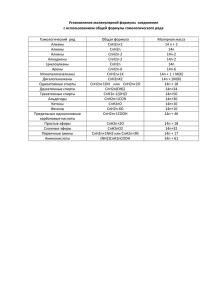
Денисова В.Г. Мастер-класс «Решение задач на вывод формул веществ» РЕШЕНИЕ ЗАДАЧ ЗАНЯТИЯ № 4 Вывод формул органических веществ с помощью уравнений реакций Первые четыре задачи не вызвали затруднений. Задача 1. . При щелочном гидролизе 2,2 г сложного эфира получено 1,7 г натриевой соли предельной одноосновной кислоты и 1,5 г спирта. Установите формулу сложного эфира (2 балла). Запишем уравнение щелочного гидролиза сложного эфира в общем виде и определим массу гидроксида натрия, вступившего в реакцию: RCOOX + NaOH → RCOONa + XOH m(NaOH) = 1,7+1,5-2,2=1г 2) Найдем количество гидроксида натрия υ(NaОН) = 1/40 = 0,025 моль Количества сложного эфира, спирта и кислоты такие же, так как в реакции все вещества участвуют в равном количестве. 3) Найдем молярную массу спирта М (ХОН) = 1,5/0,025 = 60 г/моль М(CnH2n+1ОH) = 12∙ n + 2n + 18 = 14n + 18 =60 n=3 – это С3Н7ОН 4) Найдем молярную массу cоли М(RCOONa) = 1,7/0,025 = 68 г/моль M(R) = 68-67 = 1 (водород) Формула сложного эфира НСООС3Н7 . Задача 2. При окислении оксидом меди (II) 0,92 г спирта получена смесь продуктов массой 2,52 г. Определите формулу спирта (2 балла). CnH2n+1ОH +CuO →Cu + H2O + CnH2nО m(CuO) = 2,52-0,92=1,6г υ(CuО) = 1,6/80 = 0,02 моль По уравнению реакции: υ(CnH2n+1ОH) = υ(CuО) = 0,02 моль М(CnH2n+1ОH) = 12∙ n + 2n + 18 = 14n + 18=0,92/0,02 =46г/моль n=2 – это С2Н5ОН Задача 3. 4 г алкина может максимально присоединить 32 г брома. Определите формулу алкина (3 балла). CnH2n-2 +2Br2 → CnH2n-2Br4 υ(Br2) =32/160=0,2моль по уравнению υ(CnH2n-2 ) =1/2 υ(Br2) =0,1 моль М(CnH2n-2) = 12 ∙ n + 2n – 2 = 14n – 2 = 4/0,1 = 40г/моль n=3 – это С3Н4 Задача 4. При межмолекулярной дегидратации 2,3 г предельного одноатомного спирта получено 1,85 г простого эфира. Определите формулу эфира. Решите задачу двумя способами (5 баллов). 1 способ. 1) Запишем уравнение в общем виде: 2 CnH2n+1ОH → CnH2n+1–О–CnH2n+1 + H2O 2) по закону сохранения массы: m(H2O) = 2,3 – 1,85 = 0,45 г; υ(Н2O) = 0,45/18 = 0,025 моль Денисова В.Г. Мастер-класс «Решение задач на вывод формул веществ» 3) По уравнению υ(CnH2n+1ОH) = υ(H2O) = 0,05 моль 4) М (CnH2n+1ОH) = 2,3/0,05 = 46 г/моль 5) М(CnH2n+1ОH) = 14n +18 =46 n = 2, C2H5 – О - C2H5 СПОСОБ 2. 1) Запишем уравнение в общем виде: 2 CnH2n+1ОH → CnH2n+1 О CnH2n+1 +H2O 2) По уравнению υ(CnH2n+1ОH) = 2υ(CnH2n+1 О CnH2n+1), выразим их количества через массы и молярные массы υ(CnH2n+1ОH) = 2.3 /(14n +18) υ(CnH2n+1 О CnH2n+1) = 1,85 /(28n+18) 3) Приравняем количества углеводородов и решим уравнение: 2,3 /(14n + 18) = 2∙1,85 /(28n+18); n = 2 Ответ: C2H5 – О - C2H5 Задача 5. Одно и то же количество некоторого алкена при взаимодействии с галогеноводородами образует 16,125 г хлоралкана и 27,25 г бромалкана. Установите формулу алкена. Решите задачу двумя способами (6 баллов). СПОСОБ 1. Решение: 1) CnH2n + HСl → CnH2n+1Сl CnH2n + HBr → CnH2n+1Br 2) Δm = 27.25 – 16.125 = 11.125 г ΔМ = (14n + 81) - (14n + 36.5) = 44.5 г /моль 3) υ(CnH2n) = Δm /ΔМ; υ(CnH2n) = 11.125/44.5 = 0,25 моль 4) М (CnH2n+1Br) = 27.25/0,25 = 109 г/моль 5) М(CnH2n+1 Br) = 14n +81 =109: n = 2, С2Н4 - этилен СПОСОБ 2. 1) CnH2n + HСl → CnH2n+1Сl CnH2n + HBr → CnH2n+1Br 2) По условию известно, что количества галогеналканов равны, выразим их количества через массы и молярные массы υ(CnH2n+1Сl) = 16,125 /(14n+36,5) υ(CnH2n+1Br) = 27,25/(14n+81) 3) Приравняем количества галогеналканов и решим уравнение: 16,125 /(14n+36,5) = 27,25/(14n+81) , n = 2 Ответ: С2Н4 - этилен. В этой задаче некоторые использовали уравнения галогенирования, а не гидрогалогенирования алкенов. Это привело к удвоенному ответу - бутену. Такие решения не засчитывались. Задача 6. При окислении 0,1 моля органического вещества водным раствором перманганата калия получили 4,6 г карбоната калия, 6,67 г гидрокарбоната калия,11,6 г диоксида марганца и воду. Установите формулу окисленного вещества (6 баллов). Решение: 1) Найдем количества всех продуктов реакции: Денисова В.Г. Мастер-класс «Решение задач на вывод формул веществ» υ(К2CO3) = 4,6/138 = 0,033 моль 1 υ(КНCO3) = 6,67/ 100 = 0,0667 моль разделим все на наименьшее 2 υ(Mn O2) = 11,6/ 87 = 0,133 моль или умножим на 30 4 υ (СхНуОz) =0,1 моль 3 3СхНуОz + 4 KMnO4 = К2CO3 + 4MnO2 +2 КНCO3 + q H2O количество атомов углерода справа равно 3, значит х=1 Водород: 3y = 2+2q q=1,5y – 1 Кислород: 3z +16 =3+8+6 +q 3z – 1 = q Приравняем эти два выражения 1,5y – 1 = 3z – 1 Выразим у: y = 2z При z = 0 решения нет При z = 1 y = 2 С Н2О метаналь При z = 2 у = 4 С Н4О2 гидрат метаналя – неустойчивое вещество Ответ: С Н2О метаналь В этой задаче некоторые допустили расчетные ошибки, грубо округлили количества веществ, что привело к неправильным ответам. Задача 7. При окислении 0,03 моль органического вещества водным раствором перманганата калия получили 7,26 г терефталата калия, 8,28 г карбоната калия, 1,12 г гидроксида калия,17,4 г диоксида марганца и воду. Установите возможные молекулярные формулы окисленного вещества, приведите по одной структурной формуле для каждого случая (10 баллов). Решение: 1) Найдем количества всех продуктов реакции: υ(С8Н4О4К2) = 7,26/242 = 0,03 моль 3 υ(К2CO3) = 8,28/ 138 = 0,06 моль умножим на 100 6 υ(КОН) = 1,12/56 =0,02 моль 2 υ(Mn O2) = 17,4/ 87 = 0,2 моль 20 3СхНуОz + 20KMnO4 = 3 С8Н4О4К2 + 6 К2CO3 + 20MnO2 + 2КОН + q H2O сравнивая количество углерода, определяем, что х=10 водород 3y =12+2+2q q=3y–14/2 кислород 3z+80 = 12+18+2+40+q q=3z+8 приравняем 3z+8 =1,5y –7 y = 2z + 10 При z = 0, y = 10 есть решение С10Н10 Например, пара-дивинилбензол CH2=CH–C6H4–CH=CH2 При z = 1, y = 12 есть решение С10Н12О Например, CH2=CH–C6H4–CH(OH)–CH3 При z = 2, y = 14 есть решение С10Н14О2 Например, CH3–CH(OH)–C6H4–CH(OH)–CH3 При z > 2 ароматическая структура получиться не может, решений не будет В этой задаче многие сделали расчетные ошибки, при составлении структурных формул забыли, что исходное вещество – ароматическое, некоторые не учли, что в терефталате карбоксильные группы находятся в пара-положении.