Основания.
реклама

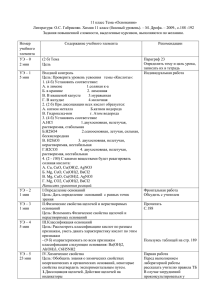
Тема «Основания» Теория Термины "кислоты" и "основания" вполне сформировались в 17 в. Их содержание неоднократно пересматривалось и дополнялось. Этот процесс происходил и происходит в острых столкновениях представителей разных взглядов на природу кислот и оснований. Развитие взглядов на кислоты и основания А. Лавуазье (1778) объяснял свойства кислот наличием в них кислорода ("кислородная теория" кислот). Однако скоро выяснилось, что очень мн. кислородсодержащие вещества (оксиды металлов, соли и др.) не обладают кислотными свойствами, а ряд типичных кислот, например, соляная, не содержат кислорода (Г. Дэви и Ж. Гей-Люссак 1810, 1814). И. Берцелиус (1802-19) устранил первое из этих противоречий, приписав оксидам знак электрического заряда. Электроотрицательные (по Берцелиусу) оксиды неметаллов образуют кислоты, электроположительные оксиды металлов - основания. В 1814 Г. Дэви высказал мнение, что атом водорода - необходимая составная часть кислот. Ю. Либих (1833) уточнил эту "водородную теорию" кислот, показав, что кислотные свойства обусловлены не любым атомом водорода, а лишь тем, который способен замещаться металлом. После появления теории электролитической диссоциации С. Аррениуса (1887) сформировалась ионная теория кислот и оснований. Согласно этой теории, кислота - водородсодержащее соединения, при электролитической диссоциации которого в воде образуются ионы водорода и анионы кислотных остатков, а основание-соединение, диссоциирующее с отщеплением гидроксид-анионов и катионов металлов. В дальнейшем появились различные варианты обобщения ионной теории кислот и оснований применительно к неводным растворителям. Эти варианты не противоречат, а дополняют друг друга, большинство их используется и разрабатывается в настоящее время. Основания– это сложные вещества, молекулы которых состоят из атома металла и одной или нескольких гидроксильных групп . Например, NaOH – гидроксид натрия, KOH – гидроксид калия, Ca(OH)2 – гидроксид кальция, Fe(OH)3 – гидроксид железа (III), Ba(OH)2 – гидроксид бария. Классификация оснований 1.По числу гидроксильных групп в молекуле основания делят на: · Однокислотные, молекулы которых содержат одну гидроксильную группу · Двухкислотные, молекулы которых содержат две гидроксильные группы · Трехкислотные, молекулы которых содержат три гидроксильные группы 2. По растворимости в воде основания делят на: · Растворимые ( щелочи) · Нерастворимые Физические свойства Все неорганические основания– твердые вещества (кроме гидроксида аммония). Основания имеют разный цвет: гидроксид калия—белого цвета, гидроксид меди(II)—голубого, гидроксид железа—красно-бурого. Химические свойства 1.Водные растворы щелочей изменяют окраску индикаторов. Индикатор лакмус фенолфталеин метилоранж Цвет в растворе щелочи синий малиновый желтый 2. Взаимодействуют с кислотами (реакция нейтрализации) «Основание + Кислота = Соль + H2O» KOH + HCl = KCl + H2O 3. Взаимодействуют с кислотными оксидами «Щелочь + Кислотный оксид = Соль + H2O» Ca(OH)2 + CO2 = CaCO3 + H2O 4. Взаимодействуют с растворами солей «Раствор щелочи + Раствор соли = Новое основание + Новая соль» 2NaOH + CuSO4 = Cu(OH)2 + Na2SO4 5. Нерастворимые в воде основания при нагревании разлагаются на основной оксид и воду «Нерастворимое основание = Основной оксид + H2O» Cu(OH)2 = CuO + H2O Хотелось обратить Ваше внимание на технику безопасности при работе с щелочами. 1. Щелочи оказывают на организм в основном локальное действие, вызывал омертвление только тех участков кожного покрова, на которые они попали. Однако в дальнейшем организм испытывает общее отравление в результате всасывания в кровь продуктов взаимодействия мышечных тканей и щелочей. Действие щелочей, особенно концентрированных, характеризуются значительной глубиной проникновения, поскольку они растворяют белок. В связи с этим очень опасно попадание щелочей в глаза: при запоздалой первой помощи возможна полная потеря зрения. 2. Твердые щелочи очень гигроскопичны. Хранить твердые щелочи следует в емкостях из полиэтилена или в толстостенных широкогорлых стеклянных банках. 3. При проведении экспериментов твердые вещества берите из баночек только сухой ложкой или пробиркой. Наливайте жидкость и насыпайте твердые вещества в пробирку осторожно. Предварительно проверьте, не разбито ли у пробирки дно и не имеет ли она трещин. 4. В случае ожога, пореза или попадания едкой и горячей жидкости на кожу или одежду немедленно обращайтесь к учителю или лаборанту. 5. При попадании щелочи на кожу необходимо промыть пораненное место обильной струей воды. Щелочь смывается плохо, промывание должно быть продолжительным (10-15 мин) и тщательным. 6. При попадании щелочи в глаза их необходимо тщательно промыть 0,2 % раствором борной кислоты. Ответьте на вопросы 1. Выпишите формулы оснований и назовите их. CuO, HNO3, NaOH, ALCl3, CO2, H3SO4 NaCl, Cu(OH)2, CuO, Fe(OH)3 назвать 2. Дайте определение оснований. 3. Назовите гидроксильную группу и ее заряд. 4. Как классифицируют основания, по каким признакам? 5. Как меняют свой цвет индикаторы в растворах оснований? 6. Что такое щелочи? В заданиях 7- 10 напишите уравнения соответствующих реакций. 7.Гидроксид калия взаимодействует с каждым из двух веществ: 1. нитратом натрия и нитратом серебра 2. гидроксидом алюминия и нитратом серебра 3) гидроксидом цинка и оксидом меди(I) 4) хлоридом бария и оксидом фосфора(V) 8.Гидроксид кальция взаимодействует с каждым из двух веществ: 1. HNO3 и CH4 2. MgO и H2SO4 3. CO2 и FeCl2 4. N2 и HCl 9.Гидроксид бария вступает в реакцию с: 1. MgO 2. KCl 3. NO 4. Al(OH)3 10.Гидроксид натрия взаимодействует с каждым из двух веществ: 1. HCl и Al2O3 2. NH3 и H2O 3.H2S и KNO3 4.MgO и HCl