otvety-k-zadanijam-vuc-2-2-i-2
реклама

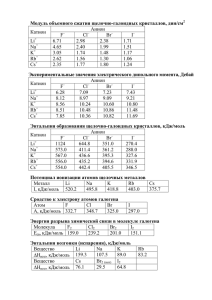
ОТВЕТЫ на задания 2, 3, 4. Обратимся к примерам 2, 3, 4, презентации. * ПРИМЕР 2. Вычислить эффективный радиус иона калия в кристаллической решётке KCl, если радиус иона хлора равен 1,811 * 10-10 м. Константа кристаллической решётки KCl равна 3,16 * 10-10 м. * Расстояние между центрами двух соседних структурных частиц (атомов,ионов) в кристаллической решётке называют константой решётки. Если исходить из предположения, что структурные частицы кристалла – касающиеся друг друга шары, то константа решётки равна сумме радиусов этих частиц. Радиусы ионов (или атомов), определяемые при таком допущении, называют эффективными радиусами, т.к.они являются радиусами сфер действия ионов (или атомов). * r(K+) равен 3,16 * 10-10 – r(Cl-) = 3,16 * 10-10 – 1,811 * 10-10 = 1,349 * 10-10 м. ПРИМЕР 3. Определение энергии ионизации элемента. * Потенциал ионизации Na J = 5,14 эВ. Вычислите энергию ионизации натрия (кДж/моль). * РЕШЕНИЕ. Энергия ионизации атома натрия ( эВ/атом) численно равна его ионизационному потенциалу, выраженному в электрон-вольтах. Так как 1 эВ = 1,602* 10-19 Дж, то энергия ионизации натрия равна: * J = 5,14 * 1,602 * 10-19 * 6,02 * 1023 = 495 кДж/моль. * ПРИМЕР 4 .Расчёт относительной электроотрицательности элемента - брома. J (Br = 1140,8 кДж/моль. Сродство брома к электрону равно 3,54 эВ/атом. * РЕШЕНИЕ. Пересчитываем сродство к электрону брома в кДж/моль: 3,54 * 1,602 * 10-19 * 6,02 * 1023 = 341,4 кДж/моль . Электроотрицательность как сумма энергии ионизации и электронного сродства элемента в кДж/моль равна: (1140,8 + 341,4 ) = 1482,2 кДж/моль. За единицу электроотрицательности принята электроотрицательность лития ( ЭО = 536,0 кДж/моль). * Относительная электроотрицательность брома равна * 1482,2 / 536,0 = 2,8 * Таблицы электронного сродства и электроотрицательностей элементов имеются в справочниках. Из примера 3 следует, что при пересчёте величин, выраженных в электронвольтах, в кДж/моль необходимо использовать соотношение 1эВ = 1,602 * 10-19 Дж или 1,602 * 10-16 кДж. Кроме того, необходимо учитывать,что потенциал ионизации выражают эВ/атом, а энергию ионизации - на моль атомов, поэтому для пересчета с атома на моль атомов необходимо использовать число Авогадро 6,02 * 1023 атомов /моль. Из примера 4 следует, что для перевода электроотрицательности, выраженной в кДж/моль, в относительные единицы ( относительно лития) необходимо помнить, что относительная электроотрицательность лития принята равной единице, а выраженная в кДж/моль - 536,0 кДж/моль. ОТВЕТЫ на задания 2.3. А). Наиболее прочно соединение азота с водородом , так как они оба неметаллы и между ними возникает прочная ковалентная связь, трудно поддающаяся разрыву.В случае висмутистого водорода полуметалл висмут, для которого водородные соединения нехарактерны, если он и образует их, то они весьма неустойчивы. В). В ряду HF, HCl, HBr, HI восстановительная способность элементов возрастает и самым сильным восстановителем будет йодоводород, так как йод имеет самый большой радиус, а следовательно наименьшие энергетические характеристики и в силу возросшей «металличности» легче отдаёт электроны, т.е. восстановительные свойства усиливаются. Поскольку при этом связь водорода с йодом ослабевает, а связывающая пара электронов смещена к йоду, отщепление иона водорода облегчается, т.е. усиливаются кислотные свойства. Г). В ряду сероводород, селеноводород, теллуроводород с увеличением радиуса в этой подгруппе элементов уменьшается связь валентных электронов с ядром, т.е. появляются признаки «металличности», привносящие в соединение долю электровалентной связи, которая , как известно, слабее ковалентной, вследствие чего и прочность соединения ниже.Поэтому теллуроводород термически менее устойчив. Д). Окислительная способность кислородсодержащих хлорных кислот зависит не только от степени окисления хлора, но и от стабильности соединения. Согласно логике, чем больше электронов отдал элемент на образование связей, тем больше будет у него стремление вернуть их обратно, так как энергетические характеристики каждого последующего электрона будут всё выше и ,следовательно, окислительные свойства будут нарастать с увеличением валентности элемента. Из этих рассуждений можно сделать вывод, что самым сильным окислителем в ряду хлорных кислот будет хлорная кислота. Однако на практике самым сильным окислителем оказывается кислота хлорноватистая, вследствие своей неустойчивости. При её разложении высвобождается атомарный кислород, который и обусловливает сильные окислительные свойства HClO. Поэтому самые сильные окислительные свойства будут у хлорноватистой кислоты. В ряду HClO, HClO2, HClO3, HClO4 сила кислот будет возрастать, так как связь Н – О сильно поляризована в сторону кислорода, который стремится восполнить частичную потерю своей электронной плотности, имеющую место вследствие поляризации ковалентной связи O – Cl. Чем больше валентность хлора, тем сильнее он оттягивает электронную плотность от кислорода, тем сильнее в свою очередь кислород оттягивает электронную пару от водорода, облегчая его отрыв от молекулы, т.е. усиливая кислотные свойства. HClO4. – одна из самых сильных неорганических кислот. Е).Сила кислот в ряду серная, селеновая, теллуровая будет уменьшаться, так как с увеличением радиуса атомов в подгруппе сверху вниз уменьшаются энергетические характеристики атомов, а следовательно появляются признаки «металличности», что ведёт к уменьшению кислотных свойств. Ж).а). Гидроксид цезия более сильное основание, так как сверху вниз в подгруппе щелочных металлов увеличиваются радиусы атомов, уменьшаются их энергетические характеристики, что приводит к увеличению «металличности» и основных свойств гидроксидов. б). Ва(ОН)2 более сильное основание по тем же причинам. в). Zn(OH)2 , более сильное основание, чем гидроксид кадмия .В побочных подгруппах сверху вниз радиусы атомов уменьшаются вследствие сжатия электронных оболочек, так как рост заряда ядра элементов не компенсируется появлением нового электронного уровня, потому что f – электроны помещаются на предвнешний f – подуровень. З). а)Более сильной кислотой по сравнению с сернистой является серная; ( смотри рассуждения в п.Д). б) Фосфорная кислота сильнее ванадиевой так как фосфор – неметалл, более электроотрицательный элемент, чем переходный металл – ванадий, поэтому поляризация связей Р – О будет сильнее, чем V – О и водород в фосфорной кислоте будет более свободен, чем у ванадиевой. в). Сернистая кислота будет более сильной, чем селенистая, так как вследствие увеличения радиуса у селена проявляются признаки «металличности», для которых не характерны кислотные свойства, поэтому мы наблюдаем их уменьшение.