ÃËÀÂÀ 17 - Центр Компьютерной Томографии
реклама
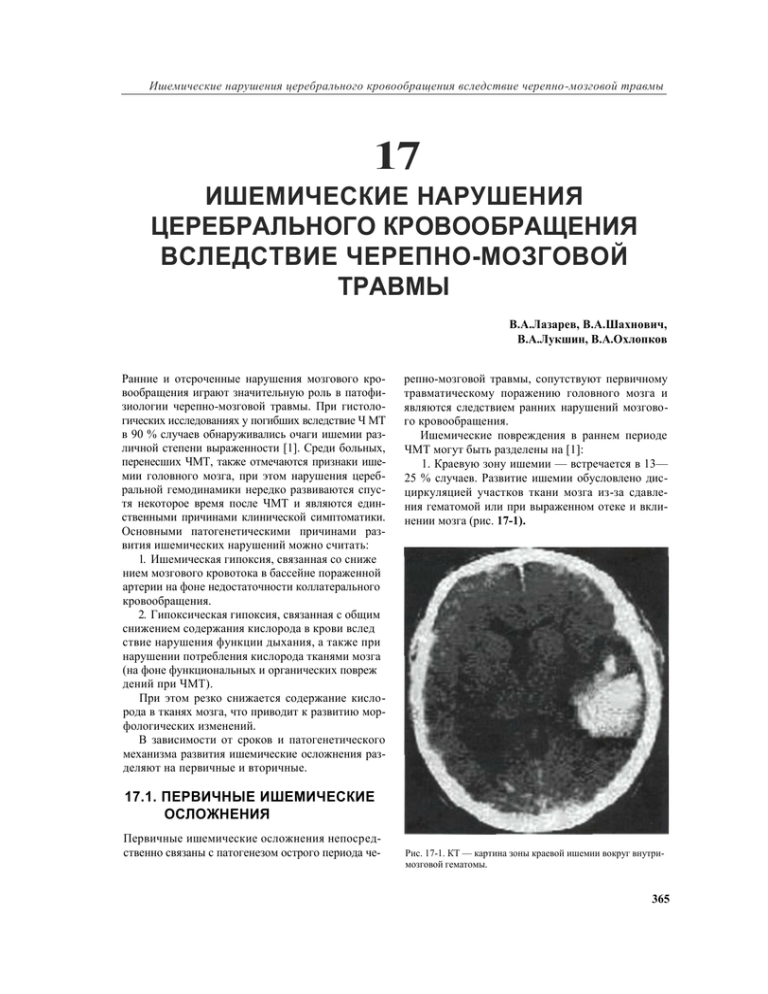
Ишемические нарушения церебрального кровообращения вследствие черепно-мозговой травмы 17 ИШЕМИЧЕСКИЕ НАРУШЕНИЯ ЦЕРЕБРАЛЬНОГО КРОВООБРАЩЕНИЯ ВСЛЕДСТВИЕ ЧЕРЕПНО-МОЗГОВОЙ ТРАВМЫ В.А.Лазарев, В.А.Шахнович, В.А.Лукшин, В.А.Охлопков Ранние и отсроченные нарушения мозгового кровообращения играют значительную роль в патофизиологии черепно-мозговой травмы. При гистологических исследованиях у погибших вследствие Ч МТ в 90 % случаев обнаруживались очаги ишемии различной степени выраженности [1]. Среди больных, перенесших ЧМТ, также отмечаются признаки ишемии головного мозга, при этом нарушения церебральной гемодинамики нередко развиваются спустя некоторое время после ЧМТ и являются единственными причинами клинической симптоматики. Основными патогенетическими причинами развития ишемических нарушений можно считать: 1. Ишемическая гипоксия, связанная со сниже нием мозгового кровотока в бассейне пораженной артерии на фоне недостаточности коллатерального кровообращения. 2. Гипоксическая гипоксия, связанная с общим снижением содержания кислорода в крови вслед ствие нарушения функции дыхания, а также при нарушении потребления кислорода тканями мозга (на фоне функциональных и органических повреж дений при ЧМТ). При этом резко снижается содержание кислорода в тканях мозга, что приводит к развитию морфологических изменений. В зависимости от сроков и патогенетического механизма развития ишемические осложнения разделяют на первичные и вторичные. репно-мозговой травмы, сопутствуют первичному травматическому поражению головного мозга и являются следствием ранних нарушений мозгового кровообращения. Ишемические повреждения в раннем периоде ЧМТ могут быть разделены на [1]: 1. Краевую зону ишемии — встречается в 13— 25 % случаев. Развитие ишемии обусловлено дисциркуляцией участков ткани мозга из-за сдавления гематомой или при выраженном отеке и вклинении мозга (рис. 17-1). 17.1. ПЕРВИЧНЫЕ ИШЕМИЧЕСКИЕ ОСЛОЖНЕНИЯ Первичные ишемические осложнения непосредственно связаны с патогенезом острого периода че- Рис. 17-1. КТ — картина зоны краевой ишемии вокруг внутримозговой гематомы. 365 Клиническое руководство по черепно-мозговой травме 2. Сегментарную зону ишемии — встречается в 17—19% случаев и связана с проксимальным по ражением артерии мозга и развитием дисциркуляции в бассейне поврежденной артерии. 3. Диффузные ишемические нарушения — встре чаются в 28—42 % случаев и связаны в первую оче редь с явлениями вазоспазма. Как правило, наблюдается сочетание сразу нескольких вариантов ишемических повреждений головного мозга. В развитии острых ишемических нарушений в зависимости от сроков и характера гемодинамических изменений можно выделить следующие 4 фазы [2]: 1. Стадия гипоперфузии. Отмечается в течение первых 24 часов с момента ЧМТ в среднем почти у трети больных [3, 4, 5]. При этом наблюдается рез кое снижение локального мозгового кровотока до значений 18—20 мл/мин./100 гр. ткани и ниже вследствие гипотензии на фоне нарушения ауторегуляции. Кроме того, возможна гипоксия из-за на рушений функции дыхания при ЧМТ. 2. Стадия гиперемии. Отмечается сразу после пе риода гипоперфузии у 15 % больных после сред ней и тяжелой ЧМТ, приходится на 1—3 дни пос ле ЧМТ и сопровождается значительным увели чением мозгового кровотока. Патогенетический ме ханизм начала и окончания фазы гиперемии в на стоящее время активно обсуждается. Отмечается, что развитие гиперемии не связано с динамикой артериального давления [3]. Поданным В G Ander sen и A. Marmarou [6] к возможным причинами развития гиперемии можно отнести повышения церебрального метаболизма глюкозы. На основа нии результатов транскраниальной допплерографии церебральных сосудов, отмечающей резкое падение цереброваскулярного сопротивления, выдвигается гипотеза метаболической вазодилятации вследствие повышения концентрации лактата, аденозина и нейропептидов при поврежде нии тканей мозга [7]. Альтернативным механиз мом снижения периферического сопротивления при ЧМТ считают дисфункцию гладкомышечных элементов в составе сосудистой стенки [8]. Окон чание стадии гиперемии связывают с вымывани ем вазоактивных веществ, восстановлением фун кции гладко мышечного слоя сосудистой стенки и разрешением гипергликолиза. 3. Стадия вазоспазма. Как правило, развивается на 4 день после ЧМТ, сменяя при этом фазу гипере мии, и продолжается в течение 2 недель (до 14 дня после ЧМТ). По данным литературы, частота раз вития вазоспазма колеблется от 18,6 % [9] до 40% 366 [10]. Церебральный вазоспазм является одним из наиболее грозных ишемических осложнений и приводит к выраженной клинической симптоматике. Основной причиной развития ангиоспазма считается возникновение посттравматического внутричерепного кровоизлияния [11]. 4. Стадия разрешения. После 2 недели с момента ЧМТ отмечается постепенное восстановление исходных параметров церебральной гемодинамики. 17.1.1. Диагностика и тактика лечения Как правило, клиническая симптоматика ишемических поражений замаскирована обшей тяжестью первичных поражений головного мозга и проявляется утяжелением состояния, прогрессированием угнетения уровня сознания. Очаговая неврологическая симптоматика развивается позже и связана со степенью ишемических поражений при каждой стадии нарушения мозгового кровообращения. Выраженная и продолжительная гипоперфузия в первом периоде, а также стойкая гиперемия во втором периоде, приводящая к вторичному повышению внутричерепного давления, считаются плохими прогностическими признаками [12J. Неврологическая симптоматика может появиться через различные периоды времени после ЧМТ — от нескольких часов до нескольких дней. В процессе нарастания церебрального ангиоспазма степень выраженности этих клинических симптомов постепенно увеличивается, а при благоприятном течении заболевания начинается обратное развитие вплоть до полной нормализации церебральной гемодинамики [13]. В зависимости от локализации церебрального ангиоспазма возникают клинические синдромы средней мозговой артерии, передней мозговой артерии, задней мозговой артерии, а также нарушения кровообращения по ишемическому типу в вертебро-базилярной системе. Одним из наиболее эффективных методов диагностики нарушений мозгового кровообращения является транскраниальная церебральная допплерография [14]. При этом в первом периоде нарушений отмечается выраженное снижение пиковой ЛСК в церебральных сосудах. Для второго периода характерны нормальные величины, и даже возрастание ЛСК. При этом снижается пульсационный индекс, что свидетельствует о снижении периферического сопротивления. Аналогичная картина характерна и для ангиоспазма. Для дифференциальной диагностики церебрального ангиоспазма и Ишемические нарушения церебрального кровообращения вследствие черепно-мозговой травмы гиперемии используют индекс Линдегарда [15], или полушарный индекс, который характеризует отношение скорости кровотока в средней мозговой артерии и скорости кровотока во внутренней сонной артерии на той же стороне. Для гиперемии полушарный индекс не превышает 3. Значение средней ЛСК в СМА более 120 см/сек соответствует слабой степени вазоспазма. При значении ЛСК от 120 до 160 см/сек, и полушарном индексе от 3 до 4 единиц говорят о ангиоспазме средней тяжести, при средней ЛСК более 160 см/сек, и полушарном индексе более 4 единиц — о грубом церебральном вазоспазме. Другим методом диагностики церебрального вазоспазма является церебральная ангиография. Лечение и профилактика ишемических осложнений должны обязательно учитываться при ведении больных с ЧМТ в остром периоде травмы. При первой фазе нарушений кровообращения показано поддержание нормальных значений церебрального перфузионного давления, гематокрита, обеспечение адекватной вентиляции легких. Во второй фазе целесообразно проведение гипервентиляции легкий, поддержание церебрального перфузионного давления. На стадии церебрального вазоспазма обычно назначают нимодипин, по назначению проводят ангиопластику. 17.2. ВТОРИЧНЫЕ ИШЕМИЧЕСКИЕ ОСЛОЖНЕНИЯ Вторичные ишемические осложнения обусловлены посттравматическими нарушениями циркуляции вследствие повреждения магистральных артерий головы и крупных церебральных сосудов в составе артериального круга большого мозга. К наиболее характерным повреждениям сосудов можно отнести: 1. Субинтимальные кровоизлияния 2. Диссекции 3. Посттравматические окклюзии 4. Разрывы 5. Артериовенозные соустья 6. Сдавления артерий гематомой В зависимости от выраженности и времени клинических проявлений вторичные ишемические нарушения можно разделить на: 1. Обширные — характерны для поражения магистральных артерий головы, крупных церебральных артерий на фоне несостоятельности коллатерального кровообращения. К этой группе также относятся диффузные ишемические поражения вследствие выраженного вазоспазма. Проявляются стой- кой неврологической симптоматикой, значительным утяжелением общего состояния. 2. Фокальные — характерны для поражения срав нительно некрупных церебральных артерий 3. Отсроченные — характерны для субинтимальных кровоизлияний, диссекции, артерио-венозных соустий. Отстроченное появление клинической симптоматики связано с прогрессированием по ражения артерии и возможным переходом субинтимального кровоизлияния в диссекцию и тром боз, а также с клинической декомпенсацией по ражений (соустья). При этом тяжесть клинической симптоматики зависит от состоятельности колла терального кровообращения. Как правило, вторичные нарушения мозгового кровообращения могут возникать в любой период после черепно-мозговой травмы. В раннем периоде на фоне острых нарушений церебральной гемодинамики, связанных прежде всего со срывом ауторегуляторных механизмов, гипотензией, повышением периферического сопротивления и вазоспазмом, выраженные вторичные ишемические нарушения являются причиной резкого утяжеления состояния больного. Такая клиническая картина характерна для диффузных ишемических нарушений вследствие тромбоза магистральных и крупных церебральных сосудов. Другой вариант клинического течения характерен для фокальных и отсроченных вторичных ишемических нарушений, когда клиническая симптоматика замаскирована общей тяжестью состояния или проявляется в более поздний период. 17.2.1 .Диссекции и тромбозы магистральных и церебральных артерий К наиболее часто встречающимся причинам развития тромбоза экстракраниального сегмента внутренней сонной артерии относят резкое сгибание [16J и разгибание шеи [17], а также непосредственный удар при травме в область шеи в проекции внутренней сонной артерии. При этом, как правило, всегда остается раневой след на шее. Повреждение артерии приводит к диссекции интимы в месте повреждения с развитием окклюзии [18] или стеноза [19], в последствии переходящего в дистальный тромбоз. Повреждение каменистого отдела внутренней сонной артерии встречается при обширных переломах основания черепа и нередко сопровождается каротидно-кавернозными соустьями [20]. 367 Клиническое руководство по черепно-мозговой травме Повреждение церебральных артерий является, как правило, следствием сдавления артерии гематомой, а также дислокации с развитием вклинений. Наиболее часто при этом страдают передние и задние мозговые артерии, а также интракраниальный отдел внутренней сонной артерии (рис. 17-2,3). Другим механизмом травмы можно считать повреждение артерии вследствие ее удара о передний наклоненный отросток при резких движениях головного мозга в передне-заднем направлении при ЧМТ. Такие повреждения в большей степени характерны для супраклиноидного отдела внутренней сонной артерии. Рис. 17-3. МРТ выявляет ишемический очаг в медиальных отделах правой затылочной доли вследствие компрессии правой задней мозговой артерии при тенториальном вклинии 17.2.2. Артерио-венозные соустья Рис. 17-2. КТ — картина ишемического инсульта в бассейне правой внутренней сонной артерии вследствие ее окклюзии. Кроме того отмечается субдуральнам гематома на противоположной стороне. По данным [21, 22] одним из механизмов развития тромбоза церебральных артерий преимущественно у молодых людей с закрытой черепно-мозговой травмой можно считать диссекцию аневризм интракраниальных сосудов. Поражение вертебро-базилярного бассейна при черепно-мозговой травме прежде всего связано с диссекциями и тромбозами позвоночных артерий. Основным механизмом развития диссекций считаются резкие сгибания и разгибания в шейном отделе позвоночника, приводящие травмированию артерии в канале поперечных отростков костными структурами позвонков. 368 Артерио-венозные соустья являются, как правило, следствием тупой черепно-мозговой травмы с переломом основания черепа. Чаще всего, соустья развиваются в течение нескольких дней после травмы и локализуются в области кавернозного синуса — каротидно-кавернозные соустья. Кроме того возможны образования других артерио-венозных соустий [23]. Основным патогенетическим механизмом развития ишемических нарушений при каротидно-кавернозных соустьях является обкрадывание бассейна внутренней сонной артерии за счет шунтирующего кровотока в соустье. Начальные ишемические проявления соустий могут быть стерты из-за компенсаторных возможностей коллатерального кровообращения головного мозга. Клиническая симптоматика проявляется при наступлении декомпенсации. Сроки и выраженность развития клинической симптоматики зависят от величины соустья. 17.2.3. Диагностика Особенностью вторичных нарушений мозгового кровообращения внезапное появление часто стертой клинической симптоматики в отсроченный период Ишемические нарушения церебрального кровообращения вследствие черепно-мозговой травмы после ЧМТ. Только в 10 % случаев немедленно проявляется в виде клинической симптоматики, в 55 % случаев неврологический дефицит нарастает в течение 24 часов, в 35 % случаев наблюдается асимптомное течение спустя 24 часа после ЧМТ. Клиническая картина при вторичных ишемических нарушениях после черепно-мозговой травмы представлена появлением (Б стадии декомпенсации) или отягощением очаговой и общемозговой симптоматики. Очаговая неврологическая симптоматика представлена головной болью, гемипарезами, моторной и сенсорной афазией, амаврозом, синдромом Горнера. Общемозгопая симптоматика представлена дисциркуляторной энцефалопатией. При этом часто отмечается усиленная пульсация в надключичной области, отсутствие пульса на поверхностной височной артерии. Стадия субкомпенсации протекает, как правило, с развитием транзиторных ишемических атак, длящихся в течение 24 часов, явлениями дисциркуляторной энцефалопатии. Декомпенсация проявляет себя развитием ишемического инсульта. Поражение экстракраниального отдела внутренней сонной артерии часто встречается у больных, перенесших черепно-мозговую травму с небольшим первичным поражением головного мозга. Поэтому внезапно развившийся очаговый неврологический дефицит может быть напрямую связан с поражением сонной артерии и развитием ишемического инсульта. При поражении каменистой и интракраниальной порций внутренней сонной артерии состояние больных, как правило, тяжелое, сопровождается значительным угнетением сознания и грубым неврологическим дефицитом. При этом клиническая картина вторичных ишемических нарушений замаскирована последствиями первичного поражения головного мозга, что затрудняет дифференциальную диагностику. Каротидно-кавсрнозные соустья помимо ишемических проявлений проявляются шумом в голове, пульсирующим экзофтальмом, хемозом. К основным неинвазивным методам диагностики ишемических осложнений на ранних этапах можно отнести транскраниалъную допплерографию церебральных сосудов. При этом отмечается выраженная асимметрия мозгового кровотока (> 15 %) вследствие снижение ЛСК в бассейне пораженной артерии, выявляются признаки коллатерального кровотока (при поражении ВСА) в виде инверсии кровотока по сегменту А1 гомолатеральной передней мозговой артерии, ретроградного кровотока по глазничной артерии. Для неинвазивной диагно- стики поражения внутренней сонной артерии в экстракраниальном и кавернозном отделе эффективным можно считать дуплексное сканирование брахиоцефальных артерий. При этом с высокой долей достоверности определяются тромбозы ВСА, резкое увеличение объемной скорости кровотока на стороне артерио-венозного соустья. Для выявления и оценки ишемических очагов головного мозга проводят КТ и МРТ головного мозга. Золотым стандартом при выявлении артериовенозных соустий, стенозирующей и окклюзирующей патологии церебральных сосудов является тотальная селективная церебральная ангиография. Следующее клиническое наблюдение может служить наглядной иллюстрацией клинической картины, характерной для вторичных ишемических нарушений при черепно-мозговой травме на примере диссекции внутренней сонной артерии с последующим переходом ее в тромбоз. Клиническое наблюдение: Больной Ч-в СВ., 30 лет, был доставлен в институт нейрохирургии с жалобами на умеренную головную боль в височной области справа, слабость левых конечностей. Накануне получил травму в ДТП без потери сознания, после чего был доставлен в ГКБ № 67 в удовлетворительном состоянии. Предъявлял жалобы на боли в левой половине грудной клетки. В дальнейшем, при осмотре в приемном отделении развилась слабость в левых конечностях, появилась «смазанная речь». Был переведен в институт нейрохирургии. При поступлении сознание ясное, адекватно ориентирован во времени, месте и собственном состоянии, вял, адинамичен. Глазные щели равны. Смыкание век полное. Зрачки D=S; фотореакция удовлетворительная. Поля зрения без выпадений. Корнсальный рефлекс снижен слева. Движение глазных яблок свободные. Конвергенция не нарушена. Субъективно: обоняние, вкус сохранены. Глоточный рефлекс сохранен. Центральный парез лицевого нерва слева. Рефлексы S>D, брюшные сохранены. Непостоянный отсроченный симптом Бабипского слева. Гемигипестезия слева. Высшие корковые функции сохранены, элементы моторной афазии. Ригидности мышц затылка нет. Симптом Кернига отрицательный. По данным КТ и МРТ (рис. 17-4) головного мозга выявляется обширный ишемическии очаг в правой лобно-височно-теменной области с умеренной компрессией правого бокового желудочка. При транскраниальной допплерографии сосудов головного мозга выявляются выраженная асимметрия церебральной гемодинамики со снижением кровотока в бассейне правой внутренней сонной артерии; ретроградный кровоток по глазничной артерии справа. При дуплексного сканирования брахиоцефальных артерий отмечаются эхографические признаки диссекции интимы и развившегося тромбоза правой внутренней сонной артерии (рис. 17-5), верифицированные с помощью КТ-спиральной ангиографии (рис. 17-6). На основании клинической картины и данных инструментальных методов исследования был поставлен диагноз: Иосттравматическая диссекция правой внутренней сонной артерии с развитием тромбоза. Острие нарушение мозгового кровообращения по ишемическому типу в бассейне правой средней мозговой артерии. 369 Клиническое руководство по черепно-мозговой травме Рис. 17-4. (клиническое наблюдение) Обширный ишемичсский очаг в правой лобно-теменно-височной области по данным компьютерной томографии (слева), МРТ в Т2-рсжиме (в центре) и в режиме протонной плотности (справа). Рис. 17-6. (клиническое наблюдение) Диссекция и тромбоз правой внутренней сонной артерии поданным КТ-спиральной ангиографии. Рис. 17-5. (клиническое наблюдение) по данным дуплексного сканирования визуализируется диссекция и сформировавшийся тромбоз внутренней сонной артерии Больному был проведен курс сосудистой, антикоагулянтной и ноотропной терапии. В результате состояние больного улучшилось, стал самостоятельно ходить. В удовлетворительном состоянии был переведен в специализированный стационар для продолжения реабилитационного лечения. 17.2.4. Лечение В настоящее время применяется как консервативное, так и хирургическое лечение. После диагностики вторичных ишемических нарушений, связанных с тромбозом ВСА и интракраниальных артерий, обычно проводят курс дезаггрегационной, сосудистой и ноотропной терапии. В последствии решают вопрос о хирургическом лечении. При незначительных ишемических очагах на КТ, сохранной НСА и 370 признаках выраженной декомпенсации резервов мозгового кровообращения проводят операцию по созданию экстра-интракраниального микроанастомоза между корковой ветвью СМА и теменной ветвью поверхностной височной артерии. При выявлении диссекции показано назначение антикоагулянтов и решения вопроса об экстренном хирургическом лечении. Для устранения диссекции помимо прямых хирургических вмешательств возможно проведение эндоваскулярного стентирования зоны диссекции. Лечение ККС осуществляется хирургическим путем и заключается в эндоваскулярной окклюзии соустья баллоном. 17.2.5. Прогноз и исходы Прогноз при вторичных ишемических осложнениях вследствие черепно-мозговой травмы в значительной степени зависит от состояния артериаль- Ишемические нарушения церебрального кровообращения вследствие черепно-мозговой травмы ного круга большого мозга, степени развития естественных анастомозов и состояния резервов коллатерального кровообращения. При состоятельности основных путей коллатерального кровообращения клиническая картина постравматических нарушений мозгового кровообращения скудна. Больные отмечают незначительную слабость конечностей, онемения, легкие нарушения речи, носящие преходящий характер и часто вообще не обращаются к врачам. При этом симптомы заболевания быстро подвергаются обратному развитию, отмечается эффективность терапевтического лечения. Хирургическое лечение, как правило, не показано, за исключением своевременно выявленных диссекций сонных артерий без развившегося тромбоза. В делом прогноз для жизни и трудовой деятельности благоприятный. При несостоятельности коллатерального кровообращения, исход нарушений мозгового кровообращения при черепно-мозговой травме менее благоприятный и зависит от величины ишемического очага, своевременности и адекватности консервативного лечения. При обширных ишемических очагах при отсутствии адекватного консервативного лечения прогноз для жизни неблагоприятный. Хирургическая реваскуляризация у этой категории больных проводится исключительно по показаниям и позволяет значительно улучшить качество жизни. Однако ввиду развития стойкого неврологического дефицита прогноз в отношении трудоспособность неблагоприятный. Литература 1. Graham, D. I., Adams, J. H. and Doyle, E. Ischaemic brain damage in fatal non-missile head injuries. Journal of the Neurological Sciences, 39, 213-234, 1978. 2. Martin NA, Ravish V., Deoberstein С et al Postraumatic cerebral arterial spasm. J. Neurotrauma 12:897—901, 1997. 3. Bouma GJ, Muizelaar JP, Choi SC, et al: Cerebral circulation and metabolism after severe raumatic brain injury: the elusive role of ischemia. J Neurosurg 75:685—693, 1991. 4. Bouma GJ, Muizelaar JP: Cerebral blood flow, cerebral blood volume, and cerebrovascular reactivity after severe head injury. J Neurotrauma 9 (Suppl 1):S333—S348, 1992. 5. Bouma GJ, Muizelaar JP: Evaluation of regional cerebral blood flow in acute head injury by stable xenon-enhanced computerized tomography. Acta Neurochir Suppl 59:34—40, 1993. 6. Andersen BJ, Marmarou A: Post-traumatic selective stimulation of glycolysis. Brain Res 585:184—189, 1992. 7. Dc Salles AAF, Muizelaar JP, Young HF: Hyperglyccmia, cercbrospinal fluid lactic acidosis, and cerebral blood flow in severely head-injured patients. Neurosurgery 21:45— 50, 1987. 8. Gomez CR, Backer RJ, Bucholz RD: Transcramal Doppler ultrasound following closed head injury: vasospasm or vasoparalysis? Surg Neurol 35:30—35, 1991. 9. Suwanwela C, Suwanwela N; Intracranial arterial narrowing and spasm in acute head injury. J Neurosurg 36:314— 323, 1972. 10. Weber M, Grolimund P, Seiler RW: Evaluation of posttraumatic cerebral blood flow velocities by transcranial Doppler ultrasonography. Neurosurgery 27:106—112, 1990. 11. Origitano TC, Wascher TM, Reichman OH, et al: Su stained increased cerebral blood flow with prophylactic hyper tensive hypervolemic hemodilution («Triple-H» therapy) after subarachnoid hemorrhage. Neurosurgery 27:729—748, 1990. 12. Kelly DF, Kordestani RK, Martin NA, et al: Hyperemia following traumatic brain injury: relationship to intracranial hypertension and outcome. J Neurosurg 85:762—771, 1996. 13. Wilkins RH, Odom GL: Intracranial arterial spasm associated with craniocerebral trauma. J Neurosurg 32:626— 633, 1970. 14. Aaslid, R. Transcranial Doppler examination tech niques, in Transcraniai Doppler Sonography, (ed. R. Aaslid). Springer-Verlag, Vienna, pp. 39—60, 1986. 15. Lindegaard, K. F., Nornes, H., Bakke, S. J. et al Cereb ral vasospasm diagnosis by means of angiography and blood velocity measurements. Acta Neurochirurgica (Vienna), 100, 12-24, 1989. 16. Zelenock, G, В., Kazmers, A. et al. Extracranial internal carotid artery dissections. Non-iatrogenic traumatic lesions. Archives of Surgery, 117, 425, 1982. 17. Stringer, W. and Kelly, D. Traumatic dissection of the extracranial internal carotid artery. Journal of Neurosurgery, 6, 123, 1980. 18. Schultz, U., Kutemeyer, et al Traumatic occlusion of both internal carotid arteries. Journal of Neurology, 231, 233, 1984. 19. Ueda, Т., Kikuchi, H. et al Traumatic stenosis of the internal carotid artery in children. Surgical Neurology, 26, 368, 1986. 20. Aarabi, B. and McQueen, J. Traumatic internal carotid occlusion at the base of the skull. Surgical Neurology, 10, 233, 1978. 21. Kunze, S. and Schiefer, W. Angiographic demonstration of a dissecting aneurysm of the middle cerebral artery. Neuroradiology, 2, 201, 1971. 22. Sato, O., Bascom, J. et al Intracranial dissecting aneurysm: case report. Journal of Neurosurgeiy, 35, 483, 1971. 23. Feldman, R., Hieshima, G. ct al Traumatic dural arteriovenous fistula supplied by scalp, meningeal, and cortical vessels: case report. Neurosurgery, 6, 670, 1980. 371



