← Алканы С
реклама
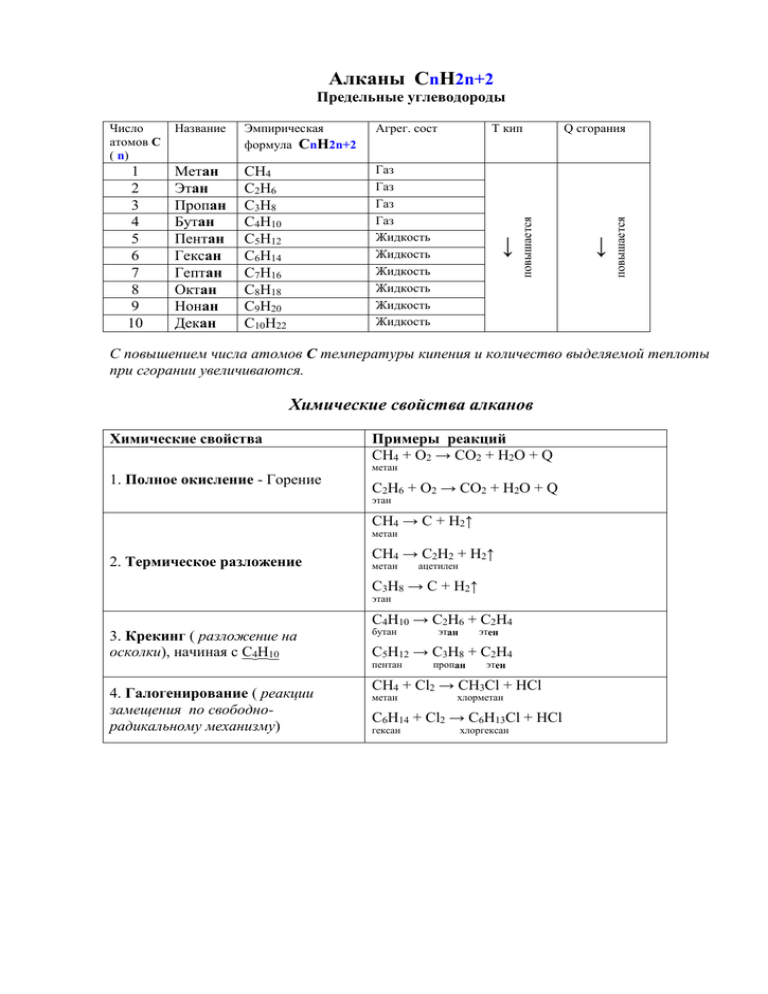
Алканы СnH2n+2 Предельные углеводороды 1 2 3 4 5 6 7 8 9 10 Метан Этан Пропан Бутан Пентан Гексан Гептан Октан Нонан Декан СН4 С2Н6 С3Н8 С4Н10 С5Н12 С6Н14 С7Н16 С8Н18 С9Н20 С10Н22 Газ Газ Газ Газ Жидкость Жидкость Жидкость Жидкость Жидкость Жидкость Т кип Q сгорания повышается Агрег. сост ← Эмпирическая формула СnH2n+2 повышается Название ← Число атомов С ( n) С повышением числа атомов С температуры кипения и количество выделяемой теплоты при сгорании увеличиваются. Химические свойства алканов Химические свойства 1. Полное окисление - Горение Примеры реакций СН4 + О2 → СО2 + Н2О + Q метан С2Н6 + О2 → СО2 + Н2О + Q этан СН4 → С + Н2↑ метан 2. Термическое разложение СН4 → С2Н2 + Н2↑ метан ацетилен С3Н8 → С + Н2↑ этан С4Н10 → С2Н6 + С2Н4 3. Крекинг ( разложение на осколки), начиная с С4Н10 4. Галогенирование ( реакции замещения по свободнорадикальному механизму) бутан этан этен С5Н12 → С3Н8 + С2Н4 пентан пропан этен СН4 + Cl2 → СH3Cl + НCl метан хлорметан С6Н14 + Cl2 → С6H13Cl + НCl гексан хлоргексан