pamyatka_-_himicheskie_svoystva
реклама
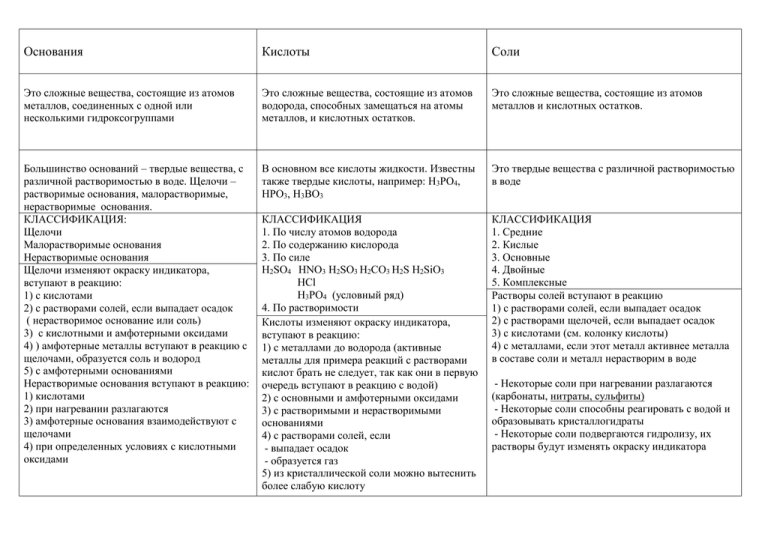
Основания Кислоты Соли Это сложные вещества, состоящие из атомов металлов, соединенных с одной или несколькими гидроксогруппами Это сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков. Это сложные вещества, состоящие из атомов металлов и кислотных остатков. Большинство оснований – твердые вещества, с различной растворимостью в воде. Щелочи – растворимые основания, малорастворимые, нерастворимые основания. КЛАССИФИКАЦИЯ: Щелочи Малорастворимые основания Нерастворимые основания Щелочи изменяют окраску индикатора, вступают в реакцию: 1) с кислотами 2) с растворами солей, если выпадает осадок ( нерастворимое основание или соль) 3) с кислотными и амфотерными оксидами 4) ) амфотерные металлы вступают в реакцию с щелочами, образуется соль и водород 5) с амфотерными основаниями Нерастворимые основания вступают в реакцию: 1) кислотами 2) при нагревании разлагаются 3) амфотерные основания взаимодействуют с щелочами 4) при определенных условиях с кислотными оксидами В основном все кислоты жидкости. Известны также твердые кислоты, например: Н3РО4, НРО3, Н3ВО3 Это твердые вещества с различной растворимостью в воде КЛАССИФИКАЦИЯ 1. По числу атомов водорода 2. По содержанию кислорода 3. По силе Н2SO4 HNO3 H2SO3 H2CO3 H2S H2SiO3 HCl H3PO4 (условный ряд) 4. По растворимости Кислоты изменяют окраску индикатора, вступают в реакцию: 1) с металлами до водорода (активные металлы для примера реакций с растворами кислот брать не следует, так как они в первую очередь вступают в реакцию с водой) 2) с основными и амфотерными оксидами 3) с растворимыми и нерастворимыми основаниями 4) с растворами солей, если - выпадает осадок - образуется газ 5) из кристаллической соли можно вытеснить более слабую кислоту КЛАССИФИКАЦИЯ 1. Средние 2. Кислые 3. Основные 4. Двойные 5. Комплексные Растворы солей вступают в реакцию 1) с растворами солей, если выпадает осадок 2) с растворами щелочей, если выпадает осадок 3) с кислотами (см. колонку кислоты) 4) с металлами, если этот металл активнее металла в составе соли и металл нерастворим в воде - Некоторые соли при нагревании разлагаются (карбонаты, нитраты, сульфиты) - Некоторые соли способны реагировать с водой и образовывать кристаллогидраты - Некоторые соли подвергаются гидролизу, их растворы будут изменять окраску индикатора НЕМЕТАЛЛЫ Простые вещества Плохо проводят электрический ток, тепло Бывают жидкие, газообразные, твердые Особые семейства неметаллов: Галогены Халькогены Вступают в реакции: 1) с металлами 2) с неметаллами ( водородом, многие взаимодействуют с кислородом и др.) 3)с водой взаимодействуют углерод и галогены МЕТАЛЛЫ Простые вещества Хорошо проводят электрический ток, тепло, ковкие, обладают металлическим блеском ОКСИДЫ (солеобразующие) Это сложные вещества, состоящие из двух элементов один из которых O (-2) Основные Кислотные Амфотерные Выделяют: - активные (есть семейства щелочных и щелочно-земельных металлов) -средней активности -неактивные (к ним относят и благородные металлы) - амфотерные металлы, которые способны образовывать амфотерные оксиды Вступают в реакции: 1) с неметаллами 2) активные металлы вступают в реакцию с водой, образуется щелочь и водород 3) металлы средней активности вступают в реакцию с водой, образуется оксид и водород 4) неактивные металлы в реакцию с водой не вступают 5)вступают в реакцию ( металлы до водорода) с растворами кислот неокислителей 5) вступают в реакцию с растворами солей, если этот металл активнее металла в составе соли и не взаимодействует с водой 6) амфотерные металлы вступают в реакцию с щелочами, образуется соль и водород 7) Многие металлы в реакциях могут быть восстановителями Это оксиды металлов с валентностью I, I I, им соответствуют основания Это все оксиды неметаллов и оксиды металлов с валентностью V, V I, V I I, им соответствуют кислоты Это оксиды металлов с валентностью I I I, I V, а также оксиды ZnO, BeO, PbO, SnO, им соответствуют основания и кислоты Вступают в реакции: 1) с кислотами 2) с кислотными оксидами 3) с амфотерными оксидами 4) оксиды активных металлов взаимодействуют с водой, образуется щелочь Вступают в реакции: 1) с щелочами 2) с основными оксидами 3) с амфотерными оксидами 4) взаимодействуют с водой, образуется кислота (кроме оксида кремния I V) 4) с некоторыми солями, если вытесняется более летучий оксид: CaCO3+SiO2= CaSiO3+ CO2↑ Вступают в реакции: 1) с кислотами 2) с кислотными оксидами 3) со щелочами 4) с основными оксидами Несолеобразующие оксиды ( N2O, NO, CO, SiO)
