Деятельность учителя
реклама

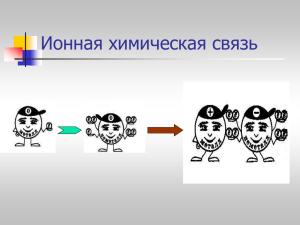
Деятельность учителя Деятельность учащихся 1) Организационный момент. 2) Подведение учащихся к активному усвоению нового материала (подводящий диалог) - Какую тему мы начали изучать? - Химическую связь. - С какими видами химической связи - С ионной и ковалентной мы познакомились? (слайд № 1-4) неполярной. - Как вы считаете, мы рассмотрели все виды химической связи? - Сегодня мы продолжим знакомство с химической связью, но с каким типом я предлагаю выяснить вместе. - Итак, какова причина образования химической связи? Почему атомы образуют химические связи? - (Давай те исходить из отрицательного опыта: атомы каких химических элементов практически не образуют химических связей? - Значит в чём причина образования связи? - Верно. Обратимся к слайду № 5 - (задание распределить предложенные формулы на группы по видам химической связи). - С какими трудностями столкнулись? - Почему? - Создание проблемной ситуации. - Какой тип связи мы можем ожидать при образовании соединений между атомами разных неметаллов? - Ковалентная связь будет отличаться от рассмотренной ранее ковалентной связи или нет? - Так какова же тема нашего урока? Что Вы хотите узнать сегодня на уроке? - (учащиеся высказывают свои предположения) - нет, потому что мы рассмотрели не все случаи возникновения химической связи (комментирование своего ответа, в каком случае возникает ионная, в каком случае ковалентная неполярная связи) - Инертные газы, так как они имеют стабильную электронную конфигурацию (имеют 8 электронов - идеал, к которому стремиться атом каждого химического элемента.) - Причина в стремлении атомов к стабильной электронной конфигурации. - Учащиеся выполняют задание. - Формула HCl не подходит под изученные виды связи. - Объяснения учащихся. - Ковалентную.За счёт общих электронных пар. - (Слайд № 7) - Итак, обратимся к следующему слайду № 7 ( рассмотрим образование связи в молекуле HCl). ВЫВОД: связь образовалась за счёт общих электронных пар. Стабильная электронная конфигурация так почему же на слайде мы видим разное отношение атомов к этому? - Да. Запись задач учащихся. Работа с диском. Виртуальная школа «Кирилла и Мефодия». Уроки химии Кирилла и Мефодия 8-9 класс. Урок 22 часть 3-5. см. приложение. Алгоритм работы с диском. Итак, почему же на слайде мы видим разное отношение атомов к этому? - Как определить силу атомов ХЭ? - Что называют ЭО? ряд ЭО Слайд № 8 Si H P C S Br Cl N O F ЭО – увеличивается. ВЫВОД: Атомы разных элементов поразному относятся к общим электронным парам. Те неМе, которые сильнее, будут оттягивать к себе общие электронные пары. Совсем как у Крылова «У сильного всегда бессильный виноват». - необходимо посмотреть на ряд ЭО элементов. - Способность атомов ХЭ оттягивать к себе общие электронные пары, называется электроотрицательностью. (обозначается ЭО). -Вернёмся к схеме образования связи в молекуле хлороводорода слайд №3 - в сторону какого ХЭ будут смещены общие электронные пары? Слайд № 5 Упражнение. Сравнить ЭО элементов. -Рассмотрим алгоритм составления схемы образования молекулы с - В сторону Cl. ковалентной полярной связью на примере HCl. Слайд № 10 - Как будет называться разновидность ковалентной связи? Какова тема нашего урока? Класс делится на 2 части. Первая работает с тестом «Виды химической связи», вторая в группах по карточкам, затем меняются. Работа в группах. 1. (на партах у учащихся карточки). Na и F Cl и Cl Ca и H H и Br H и O H и Cl Fи F K и O H и H - Покажите выигрышный путь, состоящий из пар ХЭ, между атомами которых образуется ковалентная полярная связь. - Покажите смещение общей электронной пары. 2. Из данного перечня выбрать формулы веществ с ковалентной полярной связью. Составьте схему образования молекул, воспользовавшись алгоритмом. O2 HI NaCl HI H2 CaCl2 N2 LiF HI - Подведем итог. 1.Ковалентная полярная связь образуется между ... 2. ковалентная полярная связь образуется за счёт ... 1. При составлении электронных формул с ковалентной полярной связью учитывать значение ... ХЭ. Схема. химическая связь ионная неполярная - Итог урока. - Домашнее задание. - Оценки. ковалентная полярная Учащиеся работают в группе, оформление в тетради. А) ЭО (С) ... ЭО (О) Б) ЭО (Р) ... ЭО (Сl) В) ЭО (F) ...ЭО (Br). - ковалентная полярная.