обм.пр.белк - Учебно-методические комплексы Ташкентской
реклама

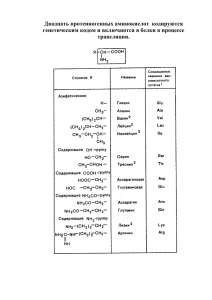
ТАШКЕНТСКАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА БИОЛОГИЧЕСКОЙ И БИООРГАНИЧЕСКОЙ ХИМИИ ЛЕЧЕБНОГО И МЕДИКО-ПРОФИЛАКТИЧЕСКОГО ФАКУЛЬТЕТОВ Тема лекции: «ОБМЕН ПРОСТЫХ БЕЛКОВ» для студентов 2 курса лечебного, медико-профилактического факультетов Рассмотрена и одобрена на учебно-методическом заседании кафедры от ____________2006 г. протокол №__________ Составитель: проф.Собирова Р.А. Ташкент - 2006 г. Рассматриваемые вопросы: 1.Переваривание, всасывание и гниение белков. 2.Судьба всосавшихся аминокислот. Общие пути катаболизма аминокислот. 3.Дезаминирование аминокислот: прямое и непрямое окислительное дезаминирование. 4.Трансаминирование. Трансаминазы, коферментная функция витамина В6, клиническое значение определения активности АлАТ, АсАТ. 5.Декарбоксилирование аминокислот. Функции биогенных аминов и пути их обезвреживания. 6.Роль гистамина в развитии аллергических и воспалительных реакций. Антигистаминные препараты. ОБМЕН БЕЛКОВ И АМИНОКИСЛОТ За сутки в организме взрослого человека обновляется до 400 г белка, с разной скоростью, причем 100 г из них распадается необратимо. Эти 100 г белка (аминокислот) должны быть компенсированы. Компенсация происходит частично за счет эндогенно синтезируемых белков, частично- поступает с пищей. Пищевая ценность белоксодержащих продуктов неоднородна. Продукт содержание белка, г/100 г сырого продукта пищевая ценность мясо 16-24 высокая Рыба 16-21 высокая сыры сычужные 20-35 высокая Яйцо 11-14 очень высокая (эталон) Молоко 3,5 высокая Картофель 1,5-2 низкая Соя 32-37 низкая Горох 24-27 низкая гречневая крупа 11-14 низкая хлеб ржаной 7-8 низкая Пути поступления аминокислот: а) транспорт из внеклеточной жидкости (при всасывании пищевых аминокислот); б) синтез заменимых аминокислот; в) внутриклеточный гидролиз белков. Пути потребления аминокислот: а) синтез белков и пептидов; б) синтез небелковых азотсодержащих соединений (никотинамид, КоА, фолиевая кислота, адреналин, норадреналин, ацетилхолин); в) синтез углеводов с использованием углеродных скелетов аминокислот; г) синтез липидов с использованием ацетильных остатков углеродных скелетов аминокислот; д) окисление до конечных продуктов обмена. Распад белков до аминокислот происходит при помощи ферментов ПРОТЕИНАЗ или КАТЕПСИНОВ. ТРИ ГРУППЫ ПУТЕЙ РАСПАДА АМИНОКИСЛОТ 1. превращения NH2- группы 2. распад углеродного скелета 3. декарбоксилирование 1. ПРЕВРАЩЕНИЯ АМИНОГРУППЫ а) восстановительное дезаминирование R-CH(NH2)-COOH + 2H R-CH2-COOH + NH3 б) гидролитическое дезаминирование R-CH(NH2)-COOH + HOH R-CH(ОН)-COOH + NH3 в) внутримолекулярное дезаминирование R-CH(NH2)-COOH R-CH=CH-COOH + NH3 г) окислительное дезаминирование R-CH(NH2)-COOH + 1/2O2 R-C(=О)-COOH + NH3 Окислительное дезаминирование характерно для большинства организмов и бывает 2-х видов: а) прямое б) непрямое (трансдезаминирование) А) прямое окислительное дезаминирование (оксидазами аминокислот), коферментыFMN, FAD: Образующиеся при этом восстановительные эквиваленты FMN.H2 окисляются каталазой в присутствии кислорода воздуха, конечный продукт- перекись водорода. Б) трансдезаминирование (основной путь катаболизма), протекает при участии аминотрансфераз или трансаминаз: Аналогично происходит превращения с аспарагиновой кислотой: Аспарагиновая кислота (АСП) + -кетоглутарат оксалоацетат (ЩУК) + ГЛУ Коферментами аминотрансфераз являются производные витамина В6 (пиридоксина)- Для катализа требуются ОБА кофермента одновременно. В условиях организма они легко синтезируются из В6 и переходят друг в друга. Механизм трансдезаминирования: В условиях организма весь азот сосредотачивается в глутаминовой кислоте, которая в митохондриях подвергается окислительному дезаминированию при помощи NAD+, NADP+ - зависимой ГЛУТАМАТДЕГИДРОГЕНАЗЫ (GDH): Декарбоксилирование аминокислот - отщепление СООН группы аминокислот в виде СО2. Продуктами этой реакции являются биогенные амины, обладающие физиологической активностью. R-CH(NH2)-COOH→R-CH2-NH2 • Декарбоксилированию подвергаются: тирозин, триптофан, 5-окситриптофан, валин, серин, гистидин, глутамат и гамма-оксиглутамат, 3,4-оксифенилаланин, цистеин, аргинин, орнитин, S-аденозилметионин и альфа-аминомалонат. Типы декарбоксилирования: • • • 1. альфа-декарбоксилирование – характерено для животных тканей. 2. омего-декарбоксилирование – характерено для микроорганизмов. 3. декарбоксилирование с трансаминированием. • 4. декарбоксилирование путем конденсации двух молекул. В данной реакции образуются сигма-аминолевулиновая кислота, сфинголипиды, биотин. • Гистамин образуется в реакции декарбоксилирования гистидина. Гистамин образуется в реакции декарбоксилирования гистидина. Физиологическая роль гистамина: • • • • • расширение артериол и капилляров, что приводит к снижению артериального давления; повышение проницаемости капилляров; возникновение внутричерепной гипертензии и головной боли, вследствие расширения капилляров мозга и выпотевания жидкой части крови; сокращение гладкой мускулатуры бронхов и развитие бронхоспазма; повышенное образование желудочного сока и слюны. Роль биогенных аминов в развитии аллергических реакций: • • • • • При сенсибилизации антигеном из тучных клеток выделяется гистамин, участвующий в развитии аллергических реакций и анафилактического шока. Для лечения их широко используются антигистаминные препараты: санорин, пипольфен, димедрол, глюкокортикоиды и др. Серотонин образуется в результате декарбоксилирования 5-окситриптофана. • • • • • • • Физиологическая роль: сужение просвета кровеносных сосудов и развитие артериальной гипертензии; терморегуляция, регуляция деятельности дыхательной системы, клубочковой фильтрации; медиатор ЦНС; способствует развитию аллергических реакций, демпинг-синдрома, токсикозов беременных, карциноидного синдрома и геморрагических диатезов. Гамма-аминомасляная кислота (ГАМК) образуется в ткане мозга из глутамата при участии глутаматдекарбоксилазы В синапсах головного и спинного мозга концентрация ГАМК и глицина высокая. Они обеспечивают в нейронах торможение передачи нервных импульсов. Обезвреживание биогенных аминов: • • Обезвреживание биогенных аминов осуществляется путем окислительного дезаминирования с образованием альдегида и аммиака при участии моноаминооксидаз (МАО) и диаминооксидаз (ДАО). МАО - кофермент ФАД, локализована во внешней мембране митохондрий, участвует в обезвреживании первичных, вторичных и тритичных аминов. • ДАО – кофермент пиридоксальфосфат, локазизована в цитоплазме, участвует в обезвреживании гистамина, путресцина, кадаверина и частично алифатических аминов. • R-CH2-NH2 → R-CH=NH • R-CH=NH + H2O → R-COH + NH3 • R-COH + 1/2O2 → R-COOH • Образовавшиеся альдегиды при участии альдегиддегидрогеназ окисляются до органических кислот.