Реферат на тему: « Принципы патогенетической терапии подагры
реклама

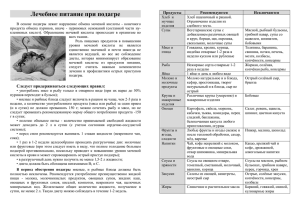
Реферат на тему: « Принципы патогенетической терапии подагры» Подагра, по-видимому, самая старая болезнь среди описанных в медицине. Именно Гиппократ в V веке до н. э. назвал подагрой (от podos – стопа + agra – капкан, ловушка) приступы острых болей в стопе. В V веке н. э. Гален описал связь тофусов с артритом, но лишь в 80-х годах XVIII века Левенгук увидел с помощью микроскопа в содержимом тофуса иглообразные кристаллы. И только в середине XX века была установлена связь подагры с кристаллами моноурата натрия (МУН). Поэтому совершенно справедливо современное определение подагры как системного тофусного заболевания, развивающегося в связи с воспалением в органах и системах в местах отложения кристаллов МУН у людей со стойкой гиперурикемией (ГУ), обусловленной внешнесредовыми и/или генетическими факторами (Насонова В.А., Барскова В.Г., 2004). Эпидемиологические закономерности подагры Среди эпидемиологических закономерностей бесспорны преимущественная заболеваемость мужчин 40-50 лет, алкоголизация и переедание, связь с широким применением диуретиков для лечения гипертонической болезни, которые, как и алкоголь, обладают способностью снижать экскрецию мочевой кислоты (МК). В последние годы отмечено поразительное учащение подагры у женщин, связанное не только с постменопаузальным периодом и прекращением урикозурического действия эстрогенов, но и с сопутствующими заболеваниями (сахарным диабетом 2 типа, артериальной гипертензией). Следовательно, стойкая гиперурикемия – важный, но не обязательный фактор риска развития подагры, поэтому неудивительно, что гиперурикемия встречается во много раз чаще, чем подагра. Например, в США ГУ отмечена у 22% обследованных, а распространенность подагры у 0,28-2,8%. В нашей стране в 80-х годах при эпидемиологическом обследовании гиперурикемия установлена у 7% населения, а подагра – у 0,1% (Беневоленская Л.И., Бржезовский М.М., 1988). Эти данные показывают, что гиперурикемия в XXI веке – большой фактор риска развития подагры, который должен учитываться при проведении дифференциального диагноза, модификации образа жизни и выбора стратегии лечения. С другой стороны, значительная распространенность гиперурикемия среди населения снижает ее диагностическую значимость. В этом отношении все большее внимание привлекают к себе классификационные критерии подагры Wallace и соавт. (1977), рекомендованные ВОЗ. Классификационные критерии A. Наличие характерных кристаллов моноурата натрия в синовиальной жидкости. B. Подтвержденный тофус (химическим анализом или поляризационной микроскопией). C. Наличие 6 из 12 клинических, лабораторных и рентгенологических признаков: 1.Максимальное воспаление сустава в первый день. 2.Наличие более чем одной атаки артрита. 3.Моноартрит. 4.Покраснение суставов. 5.Боль и воспаление плюснефалангового сустава (ПФС) I пальца. 6.Асимметричное воспаление ПФС. 7.Одностороннее поражение тарзальных суставов. 8.Подозрение на тофусы. 9.Гиперурикемия. 10.Асимметричное воспаление суставов. 11.Субкортикальные кисты без эрозий при ренггенологическом исследовании. 12. Отсутствие микроорганизмов в культуре синовиальной жидкости. В соответствии с этими критериями достоверный диагноз подагры может быть поставлен только при обнаружении кристаллов моноурата натрия в синовиальной жидкости, что возможно уже в ранней стадии болезни либо при обнаружении их в тофусах, что обычно характерно для хронической подагры редовыми и/или генетическими факторами Патогенетическую основу локальной и системной патологии при подагре составляет классическое микрокристаллическое воспаление, в основе которого лежит взаимодействие кристаллов моноурата натрия с эндотелиальными и синовиальными клетками, моноцитами/макрофагами, нейтрофилами, сопровождающееся продукцией этими клетками различных цитокинов, в частности ФНО-α, IL-lβ, IL-6. Лечение подагры Учеными проанализированы данные о частоте рецидивов и сывороточной концентрации уратов у этих больных после окончания антигиперурикемической терапии (АУТ). 160 пациентам, у которых изначально не определялись подагрические тофусы, антигиперурикемическую терапию проводили в течение 5 лет после установления диагноза, а больным с тофусами (n=51) ее отменяли через 5 лет после растворения последнего тофуса. Средняя продолжительность АУТ составила 66 мес, средняя продолжительность диспансерного наблюдения после прекращения АУТ — 33,1 мес. Уровень уратов в сыворотке крови измеряли не менее 2 раз в течение 1-го года после прекращения АУТ и затем ежегодно. Возникновение приступа подагры, подтвержденное выявлением кристаллов моноурата натрия, расценивали как рецидив. В среднем от момента прекращения АУТ до развития рецидива проходило 47 мес, при этом в течение 1 года рецидивы отмечены у 6,6% больных, в течение 2 лет— у 11,4%, в течение 3 лет — у 20,4%, и в течение 4 лет — у 29,4%. Исследователи обратили внимание на тот факт, что ни у одного пациента с концентрацией уратов в сыворотке крови <7 мг/дл за все это время не возникло ни одного подтвержденного рецидива. Постфактум выявлено, что уменьшение избыточной массы тела и применение по показаниям таких препаратов, как фибраты и антагонисты рецепторов ангиотензина II, способствовало поддержанию концентрации уратов в сыворотке крови <7 мг/дл после прекращения АУТ, а диуретики, напротив, оказались в этом отношении несостоятельны. Результаты исследования Ф. Перес-Руиса и его коллег подтверждают: на первом этапе АУТ требуются более высокие дозы соответствующих лекарственных препаратов, а после того как тофусы будут растворены, следует пожизненно проводить второй этап АУТ невысокими дозами, чтобы избежать рецидива. Авторы исследования проводят аналогию с грязной тарелкой: вначале требуется довольно много усилий, чтобы отмыть ее, а после этого достаточно регулярно протирать от пыли, чтобы поддерживать чистоту. При этом целью первого этапа является снижение концентрации уратов в сыворотке крови до 6 мг/дл, а в ходе второго этапа желательно поддерживать этот показатель на уровне 6–6,99 мг/дл. Эксперт в области подагры Элизео Паскаль (Eliseo Pascual), глава ревматологического отделения при Университете имени Мигеля Эрнандеса (Universidad Miguel Hernández), Аликанте, Испания, согласен с Ф. Перес-Руисом в том, что растворение кристаллов мочевой кислоты происходит быстрее при более низкой концентрации уратов в сыворотке крови, а при повышении этого показателя неизбежно отложение новых кристаллов как в пораженных ранее тканях, так и в ранее интактных. Для предотвращения этого следует пожизненно поддерживать не слишком высокую концентрацию уратов. Схема медикаментозного лечения подагры: • Препараты, уменьшающие гиперурикемию: - Уменьшают синтез мочевой кислоты (аллопуринол); - Урикозурические (пробенецид, сульфинпиразон, бензобромарон); - Уриколитические, повышающие растворимость мочевой кислоты в моче (магурлит, уралит). • Препараты для противовоспалительной терапии и устранения острого приступа подагры: - Нестероидные противовоспалительные препараты (НПВП): неселективные (диклофенак), селективные (мелоксикам, нимесулид, целекоксиб); - Колхицин; - глюкокортикостероиды Лечение острого приступа подагры Классическим средством для лечения острого подагрического артрита является колхицин , механизм действия которого заключается в угнетении функции лейкоцитов - миграции и фагоцитоза кристаллов уратов , а также в воздействии на экскрецию уратов и их растворимость в тканях. Колхицин применяют с начала нападения в дозе 1 мг каждые 2 ч или по 0,5 мг через 1 ч , но не более 4 мг в первые сутки. На 2 -й день дозу снижают на 1 г / сут , последующие 3 дня - по 0,5 г / сут . Препарат вызывает побочные явления со стороны желудочно - кишечного тракта ( ЖКТ) , поэтому часто его вынуждены отменять до прекращения приступа . Колхицин у больных подагрой используется уже в течение длительного времени , только в 2009 г. он был одобрен Управлением по контролю над продуктами питания и лекарственными препаратами США ( FDA). В рандомизованном контролируемом исследовании использование колхицина (1,2 мг после начала приступа с последующим приемом 0,6 мг через час ) было достоверно эффективнее , чем плацебо , в 50 % снижении интенсивности болевого синдрома на протяжении 24 ч ( RA Terkeltaub et al . ,2010). Такой режим дозирования был эффективне по сравнению с другим высокодозированным режимом ( 1,2 мг с дальнейшим приемом 0,6 мг каждый час в течение 6 ч ) , но со значительно меньшей частотой развития побочных явлений . Относительная эффективность колхицина по сравнению с различными НПВС не установлена. Для купирования приступов острого подагрического артрита сегодня используются как селективные, так и неселективные НПВП. Как известно, внутри каждой из указанных групп препаратов существуют значительные отличия в плане эффективности и безопасности. Так, из неселективных НПВП препаратом выбора для проведения симптоматической терапии у пациентов с подагрой является диклофенак, который применяется коротким курсом и имеет низкий риск возникновения желудочнокишечных кровотечений. В метаанализе L.A. Garcia Rodriguez (1998) было показано, что гастроинтестинальная безопасность диклофенака превышает таковую многих неселективных НПВП (табл.). К преимуществам этого препарата относятся отсутствие влияния на метаболизм хряща, а также хорошая переносимость, сопоставимая с таковой селективных НПВП. Кроме того,диклофенак выпускается в разных лекарственных формах, что обусловливает удобство его применения. Из селективных НПВП особого внимания заслуживает нимесулид, эффективность и безопасность применения которого при остром подагрическом артрите была изучена в ряде исследований под руководством ведущих специалистов «Институт ревматологии» РАМН (г. Москва, Россия). В ходе этих исследований были показаны такие преимущества применения гранулированного нимесулида,как быстрое наступление обезболивающего эффекта и хорошая динамика показателей внутрисуставного воспаления. В Украине зарегистрирован препарат Нимесил® (компания Berlin Chemie AG), в состав которого входит гранулированный нимесулид. Этот препарат может использоваться не только для купирования подагрических атак, но и для предупреждения их возникновения. ГКС вследствие выразительного противовоспалительного эффекта можно назначать при остром подагрическом артрите , особенно больным, у которых все указанные препараты не имели положительного эффекта. В случае резистентности к другим препаратам применяют преднизолон в дозе 30-60 мг / сут. Или метилпреднизолона в дозах 250-500 мг, с последующим снижением дозы на фоне небольших доз НПВС Лечение в межприступный период: Если обострения возникают нечасто, уровень мочевой кислоты в крови остается нормальным , медикаментозное лечение не назначают , только рекомендуют диету. В случае повышенного уровня мочевой кислоты следует применять гипоурикемических препараты. Важным компонентом терапии подагры является специальная антиподагрична диета , бедная на пурины , белки и липиды. Из рациона должен быть исключен насыщенные мясные супы , жирные сорта рыбы , бобовые , жирные молочные и мясные блюда , алкогольные напитки. Базовая терапия подагры заключается в длительном применении лекарственных средств, нормализующих содержание мочевой кислоты в крови. Самым популярным препаратом базисной терапии является аллопуринол , механизм действия которого заключается в угнетении фермента ксантиноксидазы и снижении синтеза новых пуринов. Применяют в дозе 200-600 мг / сут , по мере снижения гиперурикемии суточную дозу аллопуринола уменьшают до поддерживающей - 100 мг / сут . Механизм действия урикозурических средств заключается в снижении канальцевой реабсорбции уратов , что обусловливает повышение выделения мочевой кислоты почками . Это происходит вследствие связывания уратов белками плазмы и увеличением их фильтрации почками . Пробенецид назначают в дозе 250 мг дважды в сутки или 500 мг 1 раз в сутки. Затем дозу еженедельно увеличивают на 500 мг , пока суточное выведение мочевой кислоты с мочой не превысит 800 мг (максимальная суточная доза - 3000 мг). Начальная доза сульфинпиразона составляет 50 мг дважды в сутки , затем дозу увеличивают на 100 мг каждую неделю до нормализации содержания мочевой кислоты в крови (максимальная доза - 800 мг / сут , поддерживающая - 300-400 мг / сут). Бензобромарон назначают в дозе 100 мг в сутки , можно через день , часто его комбинируют с аллопуринолом. Клиническая эффективность уриколитичних препаратов заключается в их способности смещать рН мочи в щелочную сторону , тормозить образование оксалатных камней , растворять их. Магурлит назначают по 6-8 г в сутки. Из физиотерапевтических процедур используют диатермию , ионофорез , фонофорез гидрокортизона , диадинамические токи , грязевые и парафиновые аппликации , радоновые и сероводородные ванны , улучшающие местный обмен , трофику тканей , кровообращение , способствуют уменьшению боли и воспаления в околосуставных тканях , рассасыванию тофусов , улучшению функции суставов и общего самочувствия больных. Сегодня надежды ревматологов связаны с новым антиподагрическим препаратом – фебуксостатом, результаты изучения которого в клинических рандомизированных исследованиях были доложены на ежегодном европейском конгрессе ревматологов в 2007 г. Фебуксостат – новый непуриновый селективный ингибитор ксантиноксидазы, который, по данным двух рандомизированных контролируемых исследований, позволяет достигать более значительного снижения уровня МК в крови по сравнению с аллопуринолом у пожилых пациентов с подагрой или гиперурикемией в рандомизированных контролируемых исследованиях проводилась оценка эффективности 300 мг аллопуринола и фебуксостата в дозах 80 и 120 мг в сутки. В результате было установлено , что использования фебуксостату в указанных дозах в 2,5 и 3 раза соответственно чаще ассоциировалось с достижением целевого сыроваточного уровня мочевой кислоты менее 6 мг / дл ( 357 ммоль / л). Однако в течение первых 8 недель после инициации терапии в группе пациентов , которые использовали препарат в дозе 120 мг / сут , достоверно большее количество больных имели острые атаки подагры по сравнению с группами сравнения. В другом исследовании , в котором участвовали больные с поражением почек, использование фебуксостата в дозах 40 и 80 мг / сут были достоверно более эффективными по сравнению с Алопуринолом в дозе 300 мг / сут (или 200 мг у больных со средней степенью тяжести почечной патологии) относительно достижения целевых сывороточных уровней мочевой кислоты ( M.A. Becker et al . , 2010). Прием фебуксостата не ассоциировалось с повышением риска развития кардиоваскулярной патологии или реакций гиперчувствительности . Однако для точной оценки соотношения польза / риск от использования фебуксостата крайне необходимым является проведение дальнейших постмаркетингових исследований.