Ксеноновый-механизм-наркоза-в-свете-последних
реклама

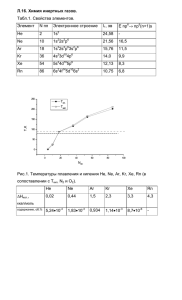
КСЕНОНОВЫЙ МЕХАНИЗМ НАРКОЗА В СВЕТЕ ПОСЛЕДНИХ ДОСТИЖЕНИЙ НАУКИ Довгуша В.В., Довгуша Л.В. В медицине и биологии человек должен использовать как естественную инертность благородных газов, так и вынужденную их реакционную способность. В первую очередь – RИзучение электронной структуры оболочек инертных газов, и в первую очередь, KR и Хе с позиций квантовой механики подсказывает, что KR и Хе способны вступить в реакции и даже без участия фтора. А о реакциях при фазовых переходах, тем более биофизических реакциях, говорится уже давно (тот же наркоз инертными газами и т.д.). С 1962 года получено более 150 химических соединений Хе, KR, Ra с фтором, кислородом, водородом, азотом, хлором. Отличие молекулы воды от всех других соединений в том, что в воде каждый протон примерно одинаково принадлежит двум атомам кислорода соседних молекул воды. В воде всегда имеются ионы обоих знаков заряда. Деформируемость атома ксенона в 20 раз больше, чем у атома гелия. Молекулы воды обладают большим сродством к электрону. Причина этого та же, из-за которой образуются водородные связи, а именно, в молекуле H2O ковалентные электроны, общие для атомов водорода и кислорода, находятся большую часть времени между этими атомами. В результате ядра атомов водорода в молекуле воды как бы оголены с одного бока от электронных облаков. К этим положительным зарядам и притягиваются посторонние электроны извне. Когда молекула H2O находится в плотном окружении других молекул воды, то это спаренные электроны других молекул воды, образующие водородную связь. Известно, что чистая вода, не содержащая микроорганизмов, при облучении её ультразвуком слегка светится в темноте (сонолюминесценция - звукосвечение). Э. Харви (1939) высказал предположение (сейчас общепризнанное), что эмиссия света под действием ультразвука осуществляется внутри газонаполненных кавитаустойчивых пузырьков. Было установлено, что инертные газы, растворенные в воде, усиливают люминесценцию в ней. При этом степень их влияния зависит от атомной массы газа, уменьшаясь от: Хе > KR > AR > Ne > Не. За 5-10 соударений между молекулами инертных газов в газовой фазе происходят процессы передачи энергии возбуждения от благородных газов к молекулам воды и дополнительному образованию ионов (Н2О) и др. Обратные процессы передачи возбуждения от молекул воды к атомам газов не могут идти, т.к. энергия возбуждения молекул Н2О меньше, чем энергия возбуждения атомов газов. Радикалы и ионы являются довольно устойчивыми частицами и, при отсутствии столкновений с другими молекулами и радикалами, способными реагировать с ними, могут существовать довольно долго. А вот возбужденные молекулы, в первую очередь Н2О*, сами по себе неустойчивы. Примерно через 10-9 сек они возвращаются в невозбужденное состояние, либо рассеивая энергию возбуждения при столкновении с другими частицами в виде колебательной (тепловой) ИК энергии, либо спонтанно излучая энергию возбуждения в виде фотонов. Это излучение близкое к 300 нм вносит основной вклад в сонолюминесценцию в воде. Согласно квантово-химическим расчетам возможность получения гидридов инертных газов в полостях молекул воды представляется реалистической. Ксенон слабо растворим в воде (85 см3/л при 37 °С). В 100 мл воды при t 20 °С растворяется: гелия - 0,86 мл неона - 10 мл аргона - 3,3 мл. Растворимость в одном литре Н2О при 0 °С мл: Не - 10; AR -60; Хе - 500. Гидраты тяжелых инертных газов более прочные. Видимо, эффект связан с различием в поляризуемости атомов инертных газов, а также с их размерами. Исследователи из Хельсинки Петтерсон М., Лунделл Я., Рассанен М. (1995) получили (после лазерного фотолиза) соединение инертного газа НХеН (дигидридксенон) – только ксенон и водород, никаких сильных окислителей. Молекула НХеН возникает в результате реакций подвижных атомов водорода. Когда два атома водорода сближаются настолько, что между ними остается лишь один атом ксенона, вместо привычной рекомбинации с образованием Н2 возникает молекула нового соединения. Конечно, наличие ковалентной связи Хе-Н делает свойства нового соединения совсем иными и в гораздо большей мере сближает его с новой семьей гидридов инертных газов. Однако, для биологических реакций необязательно наличие ковалентной связи. Достаточно ионной, водородной или ван-дер-ваальсовой. Атом водорода при колебаниях Хе-Н может смещаться очень далеко, что свидетельствует о возможности образования ионной связи. Все молекулы (НХеН, НХеОН и др.) метастабильные, богатые энергией. Разложение этих молекул ведет к возникновению водорода, ксенона и воды. Согласно расчетам энергия диссоциации этих молекул находится между 0,4 и 1,5 эВ (от 9 до 35 ккал/моль). Это означает, что такие временные соединения в принципе вполне могут быть устойчивыми при комнатной температуре. 2 В течение 5 лет группа М. Рассанена получила целую серию гидридов Хе, в том числе НХеОН (ОН обладает высоким сродством к электрону). Ещё это соединение интересно тем, что с формальной точки зрения представляет собой продукт внедрения атома Хе в молекулу воды. 1,86 Н Н Хе 1,86 6 Н Н Хе 1,73 Н Н 2,21 О Н 0,96 Н Молекула обладает большим дипольным моментом. Этими же авторами получена молекула НХеОХеН, которая также содержит молекулу воды и два атома ксенона. Схематично эту формулу можно представить в виде: О Н Хе Хе Н Н Н Молекула также обладает большим дипольным моментом благодаря двойной относительной атомной массе ксенона (131,1 х 2 = 262,2). Это самый простой кластер инертного газа. Не в этом ли механизме заключено биологическое действие инертных газов, которые просто внедряются в водородную сетку жидкой воды, уплотняя (утяжеляя) её структуру. В составе водородной сетки могут быть гидриды инертных газов, таких как НХеН, НХеОН, НХеОХеН и другие аналогичные, что предопределяет широкий спектр водных структур биологических жидкостей с встроенными молекулами. Какие же физико-химические характеристики могут способствовать растворению (взаимодействию) инертного газа в водных структурах биологических жидкостей и возникновению наркоза?: 1. Атомная масса - она у ксенона более чем в 4 раза больше, чем у азота(N2). 2. Радиус атома (радиус взаимодействия) - у ксенона почти в 1,5 раза больше, чем у азота. 3 3. Потенциал ионизации первых пяти внешних электронов - у ксенона он наименьший. 4. Энергия возбуждения электронов у ксенона в два раза меньше, чем у неона. 5. Сродство к электрону. 6. Средняя и относительная поляризуемость в 2,5 и в 20 раз у ксенона больше, чем у азота и гелия соответственно. 7. Электроотрицательность абсолютная - у ксенона наименьшая. 8. Степени окисления - имеются только у криптона и ксенона. 9. Атмосферное давление, повышенная концентрация, при которых возникает наркоз: у ксенона при нормальном давлении (0,1 МПа), у азота в шесть раз больше (0,6 МПа). 10.Содержание инертного газа в теле человека весом 70 кг при наступлении наркоза (л) - у ксенона наибольшее. 11.Содержание в водосодержащих средах (л) у ксеноа в 2-4 раза больше, чем у азота и др. газов. Таким образом, впервые представляются новые предпосылки возникновения ксенонового наркоза в свете его непосредственного взаимодействия с водными структурами биологической жидкости. 4