I шаг заочной олимпиады по химии для учащихся 8
реклама

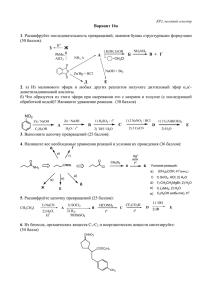
Решение III шага заочной олимпиады по химии для учащихся 8-х классов 1. На столе находятся 5 закрытых банок. Вещества А и Е – кислоты, С и D – оксиды, В – простое вещество. Вещества связаны между собой следующими процессами: А + В С + D; С + D Е Какие вещества могут находится в каждой банке? Подпишите этикетки для каждой банки, запишите уравнения согласно предложенным схемам. Решение: Вещества А – H2S и Е – H2SO3, С и D – H2O и SO2, В – O2. Вещества связаны между собой следующими процессами: 2H2S + 3O2 2H2O + 2SO2; H2O + SO2 H2SO3 2. Каким образом можно очистить газообразный азот от примесей углекислого газа и кислорода? Решение: В газовую смесь нужно внести горящий уголь (С + О2 = СО2). Когда уголь потухнет, смесь газов необходимо пропустить через избыток известковой воды (Са(ОН)2 + СО2 = СаСО3 + Н2О). 3. 10 г. смеси цинковых и медных опилок опустили в раствор соляной кислоты. По окончании реакции объем выделившегося водорода был равен 1,12 литров (н.у.). Вычислите массовую долю каждого металла смеси. Решение: С соляной кислотой реагирует только цинк (Zn + 2HCl = ZnCl2 + H2) По уравнению: n(H2) = n(Zn); n(H2) = V(H2) /Vm = 1,12/22,4 = 0,05 моль m(Zn) = n(Zn) . M(Zn) = 0,05 . 65 = 3,25 г m(Cu) = 10 – 3,25 = 6,75 г w(Zn) = 0,325, w(Cu) = 0,675 4. Чему равна доля бромида калия (в %) в его водном растворе, если известно, что в 180 г этого раствора содержится 6 моль воды? Решение: m(H2O) = n(H2O) . M(H2O) = 6 . 18 = 108 г m(KBr) = m(р-ра) – m(H2O) = 180 – 108 = 72 г w(KBr) = m(KBr)/ m(р-ра) = 72/180 = 0,4 или 40% 5. Врач и естествоиспытатель средневековья Парацельс, изучая взаимодействие железа и серной кислоты, получил газ, который назвал «горючий воздух». Впоследствии французский ученый Антуан Лавуазье получил этот газ при взаимодействии водяного пара с раскаленным железом. Что это за газ? Какие химические реакции протекали в опытах этих ученых? Какой объем газа, измеренного при н. у., выделится при взаимодействии 5 г железа с избытком разбавленного водного раствора серной кислоты. Решение: Fe + H2SO4 = FeSO4 + H2 (1) 3Fe + 4H2O = Fe3O4 + 4H2 (2) По уравнению (1) : n(H2) = n(Fe); n(Fe) = M(Fe) / m(Fe) = 5 / 56 = 0,089 моль V(H2) = n(H2) . Vm = 0,089 . 22,4 = 2 л 6. Капля дождя имеет массу около 104 г. Рассчитайте количество молекул воды и суммарное количество атомов всех элементов, содержащихся в этой капле. Решение: n(H2O) = m(H2O) / M(H2O) = 104 /18 = 0,055 .104моль N(H2O) = n(H2O) . NA = 0,055 .104 . 6. 1023 = 3,3 .1019 молекул воды В 1 молекуле Н2О – 3 атома (2 атома Н и 1 атом О), а в 3,3 .1019 – 9,9 .1019 Поздравляем победителя III шага заочной олимпиады по химии для учащихся 8-х классов ученицу 8 класса «Г» Фоменко Людмилу