РУКОВОДСТВО ПОЛЬЗОВАТЕЛЯ организация
реклама

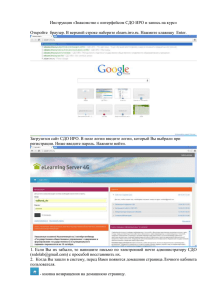
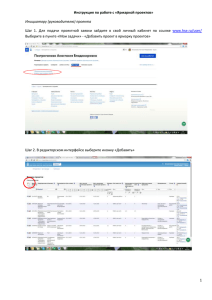
АИС «Росздравнадзора» Подсистема «Предварительный Государственный Контроль» РУКОВОДСТВО ПОЛЬЗОВАТЕЛЯ организация-заявитель Москва 2009 СОДЕРЖАНИЕ ВВЕДЕНИЕ.............................................................................................................................................. 2 1. 1.1. 1.2. НАЗНАЧЕНИЕ ПОДСИСТЕМЫ.................................................................................................................. 2 ОСНОВНЫЕ ОПЕРАЦИИ .......................................................................................................................... 2 2. ДОСТУП К ПОДСИСТЕМЕ ................................................................................................................ 3 3. ЗАЯВКИ ................................................................................................................................................... 3 3.1. СПИСОК ЗАЯВОК .................................................................................................................................... 3 3.2. ДОБАВЛЕНИЕ ЗАЯВКИ ............................................................................................................................ 4 3.2.1. Информация об используемых субстанциях............................................................................ 6 3.2.2. Номера серий лекарственных средств, подлежащих экспертизе ........................................ 7 3.3. ПОДАЧА ЗАЯВКИ.................................................................................................................................... 7 3.4. ПРОСМОТР ЗАЯВКИ ................................................................................................................................ 8 3.4.1. Сведения о заявке ....................................................................................................................... 8 3.4.2. История заявки .......................................................................................................................... 9 3.4.3. Сообщения .................................................................................................................................. 9 1 1. ВВЕДЕНИЕ 1.1. Назначение подсистемы Подсистема «Предварительный Государственный Контроль» является частью АИС «Росздравнадзора» и предназначена для автоматизации государственных функций в части осуществления предварительного государственного контроля лекарственных средств в рамках исполнения административного регламента «Организация проведения экспертизы качества, эффективности и безопасности лекарственных средств». Сотрудники организации-заявителя используют автоматизированную систему внесения сведений «Предварительный Государственный Контроль», расположенную на официальном сайте Росздравнадзора, для отправки заявок на экспертизу в Росздравнадзор. 1.2. Основные операции Сотрудники организации-заявителя работают с подсистемой «Предварительный Государственный Контроль» через модуль внешнего доступа. Модуль внешнего доступа – это внешний ресурс, расположенный на официальном сайте Росздравнадзора. Модуль внешнего доступа позволяет выполнять следующие действия: создавать заявку на предварительный государственный контроль лекарственного средства; отслеживать историю заявок. 2 ДОСТУП К ПОДСИСТЕМЕ 2. 1. Чтобы войти в подсистему «Предварительный Государственный Контроль» через модуль внешнего доступа, в адресной строке браузера введите http://pgk.roszdravnadzor.ru и нажмите клавишу Ввод. 2. Откроется страница авторизации пользователя (Рис. 1). Введите свой логин и пароль и нажмите кнопку Войти в систему. Логин и пароль предоставляются системным администратором. Рис. 1. Авторизация в модуле внешнего доступа подсистемы «Предварительный Государственный Контроль». 3. Откроется подсистема «Предварительный Государственный Контроль» (Рис. 2). Рис. 2. Главная страница подсистемы «Предварительный Государственный Контроль». 3. ЗАЯВКИ 3.1. Список заявок При входе в подсистему «Предварительный Государственный Контроль» открывается список заявок данного заявителя (Рис. 3). Рис. 3. Список заявок. 3 Для поиска заявки можно воспользоваться полем Искать, расположенным над списком. Чтобы просмотреть заявку, щелкните в соответствующей строке. 3.2. Добавление заявки 1. Чтобы добавить заявку, нажмите кнопку Добавить в верхней части окна (Рис. 4). Рис. 4. Добавить заявку. 2. Откроется окно добавления заявки (Рис. 5). Рис. 5. Добавление заявки. 3. Заполните поля формы: Производитель – отечественный или иностранный (выбирается с помощью переключателя). Номер рег. удостоверения, Дата рег. удостоверения – дата и номер регистрационного удостоверения ЛС (если у данного ЛС оно есть). Торговое наименование ЛС – после ввода даты и номера регистрационного удостоверения заполняется автоматически. Лекарственная форма – после ввода даты и номера регистрационного удостоверения заполняется автоматически. Дозировка – после ввода даты и номера регистрационного удостоверения заполняется автоматически. Форма выпуска – после ввода даты и номера регистрационного удостоверения заполняется автоматически. Производство готовой лекарственной формы – после ввода даты и номера регистрационного удостоверения заполняется автоматически. Если в таблице 4 более одного производителя, то его выбор осуществляется из списка (для иностранных производителей выбирается название организации и страна). Фасовка и (или) упаковка – после ввода даты и номера регистрационного удостоверения заполняется автоматически. Если в таблице более одного фасовщика, то его выбор осуществляется из списка (для иностранных производителей выбирается название организации и страна). Выпускающий контроль – после ввода даты и номера регистрационного удостоверения заполняется автоматически. Если в таблице более одной организации, то его выбор осуществляется из списка. Нормативная документация для контроля качества препарата – после ввода даты и номера регистрационного удостоверения заполняется автоматически. Основание для проведения предварительного государственного контроля – выпадающий список, значения списка: o Лекарственное средство, впервые производимое на территории РФ; o Лекарственное средство, выпускаемое по измененной технологии; o Лекарственное средство, выпускаемое после перерыва производства от трех и более лет; o Лекарственное средство, впервые ввозимое на территорию РФ; o Лекарственное средство вследствие выявления ухудшения его качества. Лицензия – выпадающий список лицензий организации-заявителя (со сроком действия) по виду деятельности Производство лекарственных средств, статус лицензий Действует или Возобновлена. Исходящий – исходящий номер у заявителя. Дата – дата исходящего у заявителя. 4. Нажмите кнопку Применить и подтвердите сохранение данных. Заявка будет добавлена в подсистему и откроется карточка заявки (Рис. 6). 5 Рис. 6. Карточка заявки. 3.2.1. Информация об используемых субстанциях 1. Чтобы добавить информацию об используемых субстанциях, в карточке заявки в подформе Информация об используемых субстанциях нажмите кнопку Добавить (Рис. 7). Рис. 7. Добавить информацию об используемых субстанциях. Откроется окно добавления информации об используемых субстанциях (Рис. 8). Рис. 8. Добавление информации об используемых субстанциях. 6 В полях Номер РУ и Дата РУ введите номер и дату регистрационного удостоверения. При этом остальные поля заполнятся автоматически. Если этого не случилось, введите данные вручную. Нажмите кнопку Применить и подтвердите сохранение данных. Информация об используемых субстанциях будет добавлена в заявку. 3.2.2. Номера серий экспертизе лекарственных средств, подлежащих 1. Чтобы добавить в заявку номера серий лекарственных средств, подлежащих экспертизе, в карточке заявки в подформе Номера серий лекарственных средств, подлежащих экспертизе нажмите кнопку Добавить (Рис. 7). Рис. 9. Добавить номера серий лекарственных средств, подлежащих экспертизе. Откроется окно добавления номеров серий (Рис. 8). Рис. 10. Добавление номеров серий лекарственных средств, подлежащих экспертизе. В поле Серия введите серию лекарственного средства, подлежащего экспертизе. В поле Дозировка выберите из справочника дозировку. В поле Местоположение склада выберите склад. Чтобы добавить еще одну серию, нажмите ссылку Добавить новую серию. Нажмите кнопку Применить и подтвердите сохранение данных. Номера серий будут добавлены в заявку 3.3. Подача заявки Чтобы подать заявку на рассмотрение, в карточке заявки во вкладке Заявка нажмите кнопку Подать заявку (Рис. 11). 7 Рис. 11. Подать заявку. После этого заявка становится видима в подсистеме «Предварительный Государственный Контроль» в АИС «Росздравнадзора». Дальнейшее ее редактирование становится невозможно. 3.4. Просмотр заявки Чтобы просмотреть заявку, в списке заявок щелкните в соответствующей строке. Откроется карточка заявки (Рис. 12). Карточка заявки содержит 2 вкладки: Заявка и История. 3.4.1. Сведения о заявке Во вкладке Заявка (Рис. 12) содержатся сведения о заявке: общие данные, информация об используемых субстанциях, номера серий о лекарственных средств, подлежащих экспертизе, список документов, необходимых для оформления регистрации. 8 Рис. 12. Карточка заявки, вкладка «Заявка». 3.4.2. История заявки Во вкладке История (Рис. 13) отображается информация о движении заявки и изменении ее статуса. Рис. 13. Карточка заявки, вкладка «История». 3.4.3. Сообщения При необходимости через подсистему «Предварительный Государственный Контроль» можно отправить сообщение, касающееся заявки, в лабораторию. Для этого во вкладке История соответствующей заявки нажмите ссылку Сообщения (Рис. 14). Рис. 14. Сообщения. Откроется форма отправки сообщения (Рис. 15). 9 Рис. 15. Отправка сообщения. Введите текст сообщения и нажмите кнопку Отправить. Сообщение будет отправлено в лабораторию. В этом же окне можно увидеть историю сообщений по данной заявке. 10